硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸。请回答:
(1)氨气催化氧化的化学方程式为______________________。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2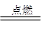 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为______________________。
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。
Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。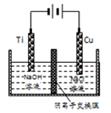
1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,
得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶
液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
| A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| B.加入NaOH溶液的体积是50mL |
| C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol |
| D.得到的金属氢氧化物的沉淀为3.12克 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60mL | B.45mL | C.30mL | D.15mL. |
氮化钠和氢化钠分别与水反应的化学方程式如下:Na3N + 3H2O=3NaOH + NH3,NaH + H2O=NaOH + H2↑。有关Na3N和NaH的叙述正确的是
| A.离子半径:Na+>N3->H+ | B.加热熔化时,都只破坏离子键 |
| C.与盐酸反应都只生成一种盐 | D.上述反应都是氧化还原反应 |
将过量铁粉放入100mL3mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为
| A.2.8g | B.6.3g | C.5.6g | D.11.2g |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60mL | B.45mL |
| C.30mL | D.15mL |
工业废气中的氮氧化物是主要污染源,为了治理污染,常通入 ,发生
,发生 反应来治理污染.现有NO、
反应来治理污染.现有NO、 混合气体3L,用同温同压下3.5L
混合气体3L,用同温同压下3.5L 使其恰好完全转化为
使其恰好完全转化为 ,则混合气体中NO、
,则混合气体中NO、 的物质的量之比为( )
的物质的量之比为( )
| A.1∶1 | B.2∶1 | C.1∶3 | D.1∶4 |
硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
(1)实验Ⅰ中,铝片作________(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是________。

查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向 右偏转。
① 反应后的溶液中含NH4+。实验室检验NH4+的方法是________。
② 生成NH4+的电极反应式是________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:

① 观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是________。
②A中生成NH3的离子方程式是________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由____________。
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O).现有由1mol NO、2mol NO2、1mol N2O4组成的混合气体恰好被1L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
| A.3 mol/L | B.4 mol/L | C.5 mol/L | D.6 mol/L |
试题篮
()