亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为__________(填化学式)。
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________(填序号)。
| A.稀硫酸 | B.二氧化碳 | C.二氧化硫 | D.磷酸 |
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:_________________________ + _________________________
上述反应后废水的pH值将________(填“增大”、“减小”或“不变”)。
(4)向20mL 0.01mol·L-1的NaNO2溶液中加入10mL 0.01 mol·L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=________________________________。(已知:KSP(AgNO2)=2×10-8 mol2·L-2)
取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L NO2气体和0.672 L N2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
| A.1 :1 | B.2 :1 | C.3 :2 | D.2 :3 |
(6分) 向27.2Cu和Cu2O的混合物中加入某浓度的稀HNO3500mL,固体完全溶解后在所得溶液中加入1mol/L 的NaOH溶液1L使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。则:
(1)Cu与Cu2O 的物质的量之比为 。
(2)HNO3的物质的量浓度为 。
Fe3O4与HNO3反应生成Fe(NO3)3、NO、H2O若溶解1mol Fe3O4,则被还原的硝酸是
| A.3 mol | B.1/2 mol | C.1/3 mol | D.9 mol |
取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化:( )
则转化过程中所加稀HNO3的物质的量浓度为( )
| A.4.4 mol·L-1 | B.3.6 mol·L-1 | C.4.0 mol·L-1 | D.3.2 mol·L-1 |
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
_ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <20CaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O).现有由1mol NO、2mol NO2、1mol N2O4组成的混合气体恰好被1L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
| A.3 mol/L | B.4 mol/L | C.5 mol/L | D.6 mol/L |
根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原剂是________,还原产物是________,氧化剂是________,氧化产物是________。
(2)还原剂与还原产物的物质的量之比是________。
(3)当有8 mol HNO3参加反应时,被氧化的物质的质量为________g,反应中转移的电子的物质的量为________ mol。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。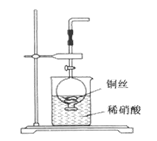
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(用化学方程式表示)。
(3)以下收集NO气体的装置,合理的是________(填选项代号)。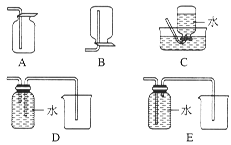
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
甲:铜 硝酸铜
硝酸铜
乙:铜 硝酸铜
硝酸铜
丙:铜 氯化铜
氯化铜 硝酸铜
硝酸铜
丁:铜 氧化铜
氧化铜 硝酸铜。
硝酸铜。
成都市近年来常常发生“毒奶粉”事件。劣质奶粉制造商为牟取暴利,大大降低了奶粉中蛋白质的含量,导致食用这种奶粉的众多婴幼儿严重营养不良乃至死亡。
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化为氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式为:2 NH3+H2SO4= (NH4)2 SO4
现取该奶粉样品100g,用“盖尔达法”分解其中的蛋白质,产生的氨气用7.5g溶质质量分数为19.6%的稀硫酸恰好完全吸收。
计算并回答下列问题:
(1)产生氨气的质量是多少?(计算结果精确到0.01,下同)
(2)含氮元素的质量多少?
(3) 该奶粉中氮的含量是否达到了国家规定的标准。(奶粉中蛋白质的含量国家标准为:每100g婴幼儿奶粉中含12g~25g。蛋白质含氮元素的质量分数为16%)
试题篮
()