2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
| A.反应后的溶液最多还能溶解1.4 g Fe |
| B.反应后溶液中c(N03-) =0.85 mol/L |
| C.反应后溶液中铁元素可能以Fe2+形式存在 |
| D.1.12 L气体可能是NO、NO2的混合气体 |
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似。相关化学性质如下图所示,下列说法不正确的是
| A.NaNO2稳定性大于NH4 N02 |
| B.NaN02与N2 H4反应中,NaN02是氧化剂 |
| C.可用KI-淀粉试纸和食醋鉴别NaN02和NaCl |
| D.分解NaN3盐每产生1 mol N2转移6 mol e一 |
从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用 +NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
饱和食盐水溶液
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |
现有一定量的铁粉和铜粉的混合物,将其平均分成四份,分别加入同浓度不同体积的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如表所示(假设硝酸的还原产物只有NO一种)。根据上表中的数据计算分析,下列推断正确的是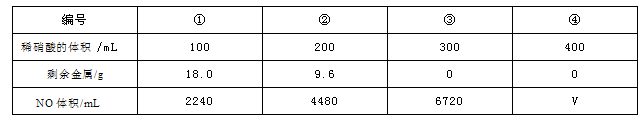
| A.①中溶解了5.6gFe | B.②中溶解了9.6gCu |
| C.硝酸的物质的量浓度为4 mol•L-1 | D.④中V=6720 |
Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2。某科学小组通过实验验证反应产物并探究产物的比例关系。资料信息:
限用如下装置实验(夹持装置省略,部分仪器可重复使用)
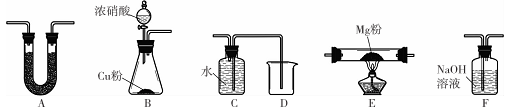
(1)装置连接的顺序为 (填字母序号);
(2)连接好仪器,装入药品前检验装置气密性的方法是____;
(3)装置A中盛装的干燥剂是 ;装置F的作用__ __;
(4)验证产物中存在Mg3 N2的具体实验操作为 .确定产物中有N。生成的实验现象为 ;
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:_ _。
(本题共14分)中学化学中有许多与氮有关的反应。阅读材料,回答问题。
氨气和氧气在催化剂存在下的反应方程式为4NH3十5O2→4NO+6H2O完成下列计算:
①生成1molNO消耗氧气的体积为 L(标准状况)。
②5 mol NH3和5 molO2反应生成4 molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/ml,则该氨水的物质的量浓度为_____mol/L。
③.如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3十3O2→2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,则产物气体中NO的物质的量为_____ mol。
已知真空管中反应2NO2
 N2O4,现向一真空管中充入4L标况下的NO2气体:
N2O4,现向一真空管中充入4L标况下的NO2气体:
① 若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol
若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(保留一位小数)。
② 将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→ NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3―0.02mol。
①所得溶液中NaNO2的物质的量为 mol;②混合气体中V(NO):V(NO2)= 。
向13.6 g由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250 mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体。在所得溶液中加入0.5 mol/L的NaOH溶液1.0 L,生成沉淀质量为19.6 g,此时溶液呈中性且金属离子已完全沉淀。下列有关说法正确的是
| A.原固体混合物中Cu与Cu2O的物质的量之比为1:1 |
| B.原稀硝酸中HNO3的物质的量浓度为1.3 mol/L |
| C.产生的NO的体积为2.24 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.1 mol |
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措。
(1)研究发现利用NH3可消除硝酸尾气中的NO污染。NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示:
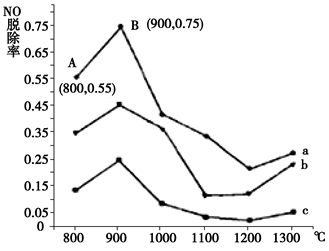
①用化学反应方程式表示NH3消除NO的反应原理 (不用注明反应条件)。
②曲线b 对应NH3与NO的物质的量之比是 。
③曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为____ mg/(m3·s)。
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3,若吸收的溶液中N的浓度为ag·L- 1,要使1m3该溶液中的完全转化为,至少需通入标准状况下的O2 L。(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4。
①NaHSO3溶液中离子浓度大小为 。
②写出生成S2的电极反应式 。
一定量的镁溶于一定浓度的硝酸的反应中,产生标准状况下的N2O气体11.2L,在所得的溶液中加入足量的氢氧化钠溶液,完全反应后过滤出沉淀,经洗涤、蒸干并充分灼烧,最后得到固体的质量为
| A.20g | B.40g | C.58g | D.80g |
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)S简单离子的原子结构示意图为 。
(2)H2O2是实验中常用的“绿色氧化剂”,1molH218O2的中子数为____________。
(3)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示_______________。
(4)粉末状的Si3N4对空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在一定条件下的密闭容器中热处理,可以得到对空气、水、和酸都相当稳定的固体材料,同时还可生成对水不稳定的Mg3N2,热处理后除去固体材料中未反应的Si3N4、MgO和Mg3N2的方法是 。
(5)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。滤液深蓝色含有铜氨络离子-[Cu(NH3)4]2+,若沉淀质量为7.8g,则合金的质量为________g。
(6)将NO和NO2组成的混合气体通入如图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2)。

已知:
(i)浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
(ii)NaOH溶液与NO2能发生反应生成两种盐和水,NaOH溶液与NO不反应。
a.装置②、③、④中盛放的药品依次是_____ ___、 、 。
b.能够说明实验已成功的现象是____ 。
CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法不正确的是
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得混合气体X一定有O2 |
| D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:1 |
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中生成氨气反应的化学方程式是 _________________;
(2)B中加入的干燥剂是_______(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象:①C中______、②D中有无色液体生成;
设计实验检验D中无色液含有水:取少量液体于试管中,加入少量_______粉末,现象为______。
(4)写出氨气与氧化铜反应的化学方程式 _______________。若收集到2.24L(STP)氮气,计算转移电子数为______________。
(14分)亚硝酸是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化为Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白中含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。说明维生素C具有 性,亚硝酸盐具有 性(填“氧化”或“还原”)
(2)NaNO2和NaCl外观相似,肉眼不易分辨。下列方法中,不能用来区分NaNO2和NaCl的是 。
| A.分别测定这两种溶液的pH值 |
| B.酸性条件下分别将两种溶液加热 |
| C.在酸性条件下分别加入KI-淀粉溶液 |
| D.分别向两种溶液中滴加AgNO3溶液 |
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出该反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,是理想的水处理剂,其与水反应生成O2、Fe(OH)3(胶体)和KOH。
① KOH的电子式
② O2的结构式
③ K2FeO4中Fe的化合价为
④上述反应的离子方程式
(8 分)将一定质量的铁粉加入到装有 100 mL 某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 mL(标准状况下)。
①所得溶液中的溶质的化学式为 。
②原硝酸溶液的物质的量浓度为 。
(2)向上述固液混合物中逐渐滴加稀硫酸直至刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式为 。
②(m-n)的值为 (精确到0.1 g)。
试题篮
()