铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现将1.92gCu放入足量的稀硫酸中,若要使铜完全溶解,理论上至少应加入NaNO3晶体的物质的量为
| A.0.02mol | B.0.045mol | C.0.06mol | D.0.08mol |
在一定条件下,将等体积的NO和NO2充入试管,并将试管倒立于水槽,充分反应后剩余气体的体积缩小为原体积的
| A.1/2 | B.1/3 | C.3/8 | D.2/3 |
亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如右图所示(部分夹持装置略)。已知: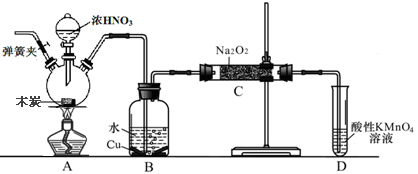
①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO与NO3-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式______________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭__________g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见右图。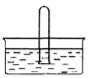
①NO2溶于水的化学方程式是_________________________。
②使试管中NO2完全被水吸收的操作是______________________________。
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
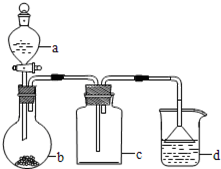
| 选项 |
a中的物质 |
b中的物质 |
c中的物质 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| |
X. |
Y |
Z |
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
KOH溶液 |
SiO2 |
浓盐酸 |
| ③ |
O2 |
N2 |
H2 |
| ④ |
FeCl3溶液 |
Cu |
浓硝酸 |
A.①③ B.①④ C.②④ D.②③
某实验过程如图所示,则图③试管中的现象是( )

| A.铜片溶解,产生无色气体,该气体遇空气变为红棕色 |
| B.铜片溶解,产生无色气体,该气体遇到空气不变色 |
| C.铜片溶解,放出红棕色有刺激性气味的气体 |
| D.无明显现象,因稀硫酸不与铜反应 |
某学习小组利用下图所示装置制备氨气,并探究氨气的性质(部分仪器略去)。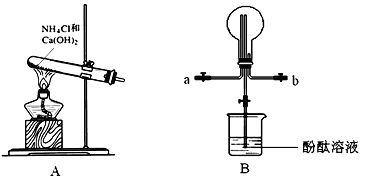
请回答下列问题:
(1)写出以A装置制备氨气的化学方程式:__________________
(2)用B装置收集氨气时,氨气的进气口是__________(填“a”或“b”)。
(3)B装置中烧瓶已收集满氨气,若要使之形成喷泉,操作方法是__________。若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_________(填序号)。
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式:_________。
(1)地壳中含量最高的金属是 ,NaHCO3俗称 ,制造计算机芯片的半导体材料是 ,水晶项链的主要成分是 。
(2)在反应3Cu+8 HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O中,失去电子的是_________(填元素符号),被还原的是_______(填元素符号)。当产生标况下4.48 L气体时消耗单质铜 g,此时转移了_______ mol电子。
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是 
| A.NO2是该过程的最终产物 |
| B.NO和O2必须在催化剂表面才能反应 |
| C.汽车尾气的主要污染成分是CO2和NO |
D.该催化转化的总反应方程式为:2NO +O2 +4CO 4CO2+N2 4CO2+N2 |
能选用右图装置正确完成的实验是
| A.用铅粒与稀硫酸制取并收集H2 |
| B.用少量MnO2和H2O2制取并收集O2 |
| C.用生石灰和浓氨水制取并收集NH3 |
| D.用浓硫酸和浓盐酸制取并收集HCl |
以下物质间的每步转化都是通过一步反应能实现的是
| A.Al→Al2O3→Al(OH)3→NaAlO2 | B.Fe→FeO→Fe(OH)2→Fe(OH)3 |
| C.S→SO3→H2SO4→MgSO4 | D.N2→NO→NO2→HNO3 |
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入2mol∙L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示。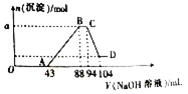
(1)写出OA段反应的离子方程式:____________________________。
(2)B点时溶液中含有溶质的化学式为____________。
(3)a的数值为__________。
(4)原硝酸溶液中HNO3的物质的量为__________mol。
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应,二者比较,相等的是( )
| A.铜片消耗完所需时间 | B.反应生成的气体体积(标准状况下) |
| C.反应中氧化剂得到的电子总数 | D.反应后溶液中硝酸根离子的浓度 |
下列关于浓硝酸和浓硫酸的叙述中正确的是
| A.常温下均可用铝制容器运输 |
| B.常温下均能与铜较快反应 |
| C.露置在空气中,容器内酸液质量都减少 |
| D.露置在空气中,容器内酸液质量都增大 |
下列气体不会造成大气污染的是( )
| A.SO2 | B.CO | C.N2 | D.NO |
试题篮
()