在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
(2)实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
| A.酒精灯 |
| B.长直玻璃导管 |
| C.锥形瓶 |
| D.直型冷凝管 |
E.尾接管(接液管)
F.蒸馏烧瓶
G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。
(3)肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1.黑色粉末是CuO;
假设2.黑色粉末是Fe3O4;
假设3. 。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。
(18分)
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构。2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色。
(1)镁与气体X反应产物的电子式为________。
(2)浓硝酸和浓盐酸反应的化学方程式为________。
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为________。
Ⅱ.石油铁储罐久置未清洗易引发火灾,经分析研究,事故由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1:3反应生成的黑色物质丙自燃引起。某研究小组将一定量的丙粉末投人足量的浓盐酸中发生反应,得到4.8g淡黄色沉淀和气体乙,乙在标准状况下的密度为1.5179g/L,过滤后向滤液(假设乙全部逸出)中加人足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,过滤、洗涤、灼烧后的固体质量为24g,已知气体乙可溶于水。请回答下列问题:
(1)甲的化学式为________。
(2)写出丙中非金属元素的离子结构示意图________。
(3)丙在盐酸中反应的化学方程式:________。(离子方程式表示)
(4)请设计合理的实验方案验证不同温度对丙与盐酸反应速率的影响
(5)为消除火灾隐患,下列措施可行的是________。
| A.石油入罐前脱硫 |
| B.定期用酸清洗罐体 |
| C.罐体内壁涂刷油漆 |
| D.罐体中充入氮气 |
某研究小组将纯净的气体通入0.1
的
溶液中,得到了
沉淀,为探究上述溶液中何种微粒能氧化通入的
,该小组突出了如下假设:
假设一:溶液中的
假设二:溶液中溶解的
(1)验证假设一
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 |
实验现象 |
结论 |
| 实验1:在盛有不含 |
假设一成立 |
|
| 实验2:在盛有不含 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的随通入
积的变化曲线入下图

实验1中溶液变小的原因是;
时,实验2中溶液
小于实验1的原因是(用离子方程式表示)。
(3)验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
(4)若假设二成立,请预测:在相同条件下,分别通入足量的和
,氧化相同的
溶液(溶液体积变化忽略不计),充分反映后两溶液的
前者(填大于或小于)后者,理由是
磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂。将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是
| A.Na3PO4 | B.Na4P2O7 |
| C.Na4P2O7和Na5P3O10 | D.Na3PO4、Na4P2O7和Na5P3O10 |
是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料]在260
和400
时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)

实验1:连接装置,检查气密性,按图示加入试剂(装置
盛0.5000
盐酸70.00
)。通入
排尽空气后,于260
加热装置
一段时间,停止加热,冷却,停止通入
。品红溶液不褪色,取下装置
,加入指示剂,用0.2000
溶液滴定剩余盐酸,终点时消耗
溶液25.00
。经检验滴定后的溶液中无
。
(1)仪器的名称是。
(2)滴定前,下列操作的正确顺序是(填字母编号)。
a.盛装0.2000溶液
b.用0.2000溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置内溶液吸收气体的物质的量是
实验2:连接装置
,检查气密性,按图示重新加入试剂。通入
排尽空气后,于400
加热装置
至
完全分解无残留物,停止加热,冷却,停止通入
。观察到装置
、
之间的导气管内有少量白色固体。经检验,该白色固体和装置
内溶液中有
,无
。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置内溶液中有
,无
的实验操作和现象是.
(5)装置内溶液吸收的气体是.
(6)在400
分解的化学方程式是.
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:____________
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.050 |
n2 |
0.080 |
0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为____________
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为 ,升高温度后,反应2NO2 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验一】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):
36.装置D的作用是 ;如果没有B装置,C中发生的副反应有 。
37.就算在装置气密性良好的情况下进行实验,该小组发现制得的NaNO2的纯度也不高,可能的原因是 ;设计一种提高NaNO2纯度的改进措施 。
【实验二】测定NaNO2样品(含NaNO3杂质)的纯度
先查阅资料知:①5NO2-+ 2MnO4-+ 6H+ → 5NO3-+ 3Mn2+ + 3H2O;
②MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
然后,设计如下方案测定样品的纯度。
38.取样品2.3g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500mol/L的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为_________。
39.通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是 (填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2 +CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
二氧化氯( ClO2)是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用“隋性”气体进行稀释,并尽可能防止震动和避光。因此,二氧化氯的制备方法一直是科学家长期寻求解决的问题,目前比较理想的方法是用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。已知,ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为一59℃,沸点为11.0℃,易溶于水。某学生拟用图1所示装置模拟工业制取并收集ClO2.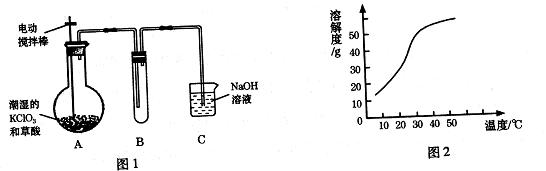
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2.3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的Ⅺ晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol∙L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32- =2I- +S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30min”,立即进行步骤3,则测定的结果可能(选填“偏大”、“偏小”或“无影响”)。
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g-L一1,(用含字母的代数式表示)。
含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
| A.a是Fe(NO3)2 | B.n1 = 0.375 | C.p = 0.20 | D.n2 = 0.30 |
氨气是一种重要的化工产品,工业上可以按照下图所示流程生产氨气:

(1)原料气之一氮气的工业制取方法是 ,写出氨气的工业用途(任答一点) 。
(2)写出合成塔中发生的反应的化学反应方程式 。在冷却塔中对混合气体进行冷却,冷水的入口 (答m或n)。
(3)设备C的作用 。其分离器中的过程对整个工业合成氨的意义 (试结合平衡移动原理回答)。
(4)在原料气制备过程中混有 CO对催化剂有毒害作用,欲除去原料气中的 CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
氮是一种重要的元素,在很多物质中都含有它的身影。
I.在9.3胜利日阅兵活动中,我国展示了多款导弹,向世界展示了我们捍卫和平的决心和能力。偏二甲肼【(CH3)2NNH2】是一种无色易燃的液体,常与N2O4作为常用火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)
(1)该反应(Ⅰ)中氧化剂是_____________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________。
2NO2 (g),一定温度下,该反应的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________。
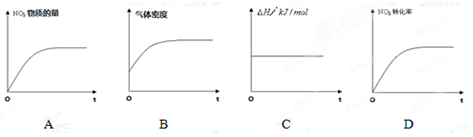
若在相同温度下,将上述反应改在体积为2L的恒容密闭容器中进行,平衡常数____________(填“增大”“不变”或“减小”),反应4min后N2O4的物质的量为0.8mol,则0~4min内的平均反应速率v(NO2)=_________________。
II.硝酸铵(NH4NO3)是一种重要的铵盐,它的主要用途作肥料及工业用和军用炸药。在25℃时,将1mol 硝酸铵溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将__________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
在l00mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5. lg。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为l00mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量( m)为9.6g>m>3. 6g |
在标准状况下,将aLNH3完全溶于1L水得到VmL氨水,溶液的密度为ρg∙cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
① ②
② ③
③ ④
④ ⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
| A.①②④ | B.②③④ | C.②④ | D.②③⑤ |
试题篮
()