在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol·L-1和1.5 mol·L-1,
现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13.44 L H2(标准状况) |
| C.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
| D.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
某澄清透明溶液中只可能含有:Al3+、Mg2+、Fe3+、Fe2+、H+、CO32-、NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( )

| A.Mg2+、 H+、NO3- |
| B.Mg2+、Fe3+、H+、NO3- |
| C.Fe3+、 H+、 NO3- |
| D.Cu2+、H+、 NO3- |
(1)二氧化硅与碳高温下反应的化学方程式为
上述反应中生成的单质有什么用途: (写一条即可)。卞石是硅酸盐,不同类型的卞石中氧原子的物质的量分数相同,由钠卞石化学式NaAlSi3O8可推知钙卞石的化学式为 ,请将钠卞石的化学式改写成氧化物的形式:
(2)天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
COS Na2S溶液
Na2S溶液 H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
已知A、B为单质,C为化合物。则下列说法正确的是( )
A+B C
C C溶液
C溶液 A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.③④ C.①③ D.②④
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )

A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应
I、II两学习小组分别进行探究性的实验:
I组:为了分别研究SO2和Cl2的性质,设计了如图所示的实验装置。

(1)若从左端分别通入SO2和Cl2,则装置I中观察到的现象是否相同? (填“相同”或“不相同”);当通入SO2时,装置III中发生反应的离子方程式为 ;该反应中SO2表现出 性。
(2)若装置II中装有5.0mL 1.0×10-3mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,则该反应的化学方程式为 。
(3)你认为乙组设计的装置是否有不足之处? (填“有”或“无”)。如果有,请写出改进方法: (如果无,此空不答)。
II组:为了探究Cl2和SO2同时通入H2O中发生的反应,设计了如图所示的实验装置。
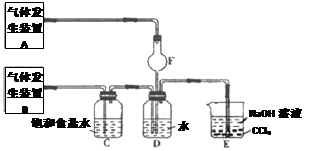
(1)气体发生装置A中产生的气体化学式为 。
(2)装置D中发生反应的化学方程式为 ;在装置D反应后所得溶液中加入BaCl2溶液,观察到的现象是 。
(3)装置C中饱和食盐水的作用是 ;装置E的作用是 。
新型无机非金属材料氮化硼(BN)可用于火箭的燃料喷嘴。已知BN可以在高温下通过:B2O3(s)+2NH3(g)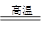 2BN(s)+3H2O(g)反应制得,实际中还添加Ca3(PO4)3作为填料,以降低B2O3熔体的黏度。下列有关说法正确的是
2BN(s)+3H2O(g)反应制得,实际中还添加Ca3(PO4)3作为填料,以降低B2O3熔体的黏度。下列有关说法正确的是
| A.反应中B2O3是氧化剂 |
| B.若消耗2.24LNH3理论上可得2.5gBN |
| C.填料的作用可使反应物充分接触 |
| D.反应时NH3需要用无水CaCl2干燥 |
现有原子序数依次增大的W、T、X、Y、Z、R六种前四周期元素.TW3能使湿润的红色石蕊试纸变蓝色.X、Y位于同一主族且Y的原子序数是X的2倍.Z、R是生活中常见金属,Z、R的器皿在潮湿空气中分别生成红褐色锈和绿色锈.
请回答下列问题:
(1)TW3的电子式为 .
(2)由W、T、X、Y中的元索组成一种离子化合物M,能发生如图转化关系:
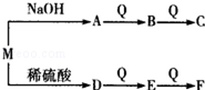
F与E的相对分子质量之差为16.则M的化学式可能为 .
C与水反应的化学方程式为 .
(3)(TW4)2Y2X8能和ZYX4在水溶液中反应生成Z2+和YX42﹣,写出离子方程式 .
(4)常温下,在WTX3浓溶液中以Z、R为电板构成原电池,负极材料是 ,
正极反应式为 .
已知:Fe(OH)3不溶于过量氨水,Cu(OH)2溶于过量氨水,转化为[Cu(NH3)4]2+。现有等物质的量组成的铁铜合金0.1mol,研成粉末后,全部投入稀硝酸中,微热使其充分反应,硝酸的还原产物只有NO,由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况。下列说法正确的是( )
| A.根据溶液中的金属离子和残留固体的成分最多会有6种情况 |
| B.若金属有剩余,在溶液中再滴入稀硫酸后,金属不会再溶解 |
| C.当合金刚好溶解时,在标准状况下产生2.24LNO |
| D.若合金全部溶解,在溶液中加入过量的氨水,经过滤、洗涤、干燥、充分灼烧,称量得固体5.35g |
常见的纯净物A、B、C、X,它们之间有如图转化关系(副产物已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为__ ______;C溶液在储存时应加入少量X,理由是_________________(用必要的文字和离子方程式表示)。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质溶液,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为________或________(写出不同类物质),反应①的离子方程式为_____________或__________。
下图为海水综合利用的工业流程图,判断下列说法正确的是
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体,而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、E的化学式:A_______________;B_______________;E_______________
(2)写出F和H反应的化学方程式 。
(3)按要求写方程式:
① 加热固体D发生反应的化学反应方程式 。
② C与足量盐酸反应的离子方程式 。
③ A溶液与金属铝反应的离子方程式 。
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4) C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
磷化铝是用红磷和铝粉烧制而成。因杀虫效率高、经济方便而应用广泛。可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片)。
(1)写出磷化铝的化学式:________;举一例红磷的同素异形体,写出其化学式:________。
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:____________________________________________________________。
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:___________________________________________。
(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是____________________________________。
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10·6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10·6H2O="==" Na3HP2O7+X+5H2O,请你推出X的化学式:__________________;并且写出X溶液中离子电荷守恒的等式:___________________________。
试题篮
()