下列设计的实验方案能达到实验目的是( )
| A.制备Al(OH)3悬浊液:向1mol•L﹣1AlCl3溶液中加过量的6mol•L﹣1NaOH溶液 |
| B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机相的水 |
| C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中滴加KSCN溶液,再加入少量新制氯水,观察实验现象 |
| D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象现象 |
(14分,每空2分)下列关系图中,A是一种正盐,E是强酸,当甲无论是强酸或强碱都有如下反应关系:

友情提示:当甲无论是强酸或强碱,A、B、C、D、E均为同种元素对应的不同的化合物。
回答下列问题:
(1)A是 (用化学式表示)
(2)当甲是稀盐酸溶液时,B为具有臭鸡蛋气味的气体
①写出B与C的反应方程式:
②一定质量的Zn与100mL 12.0mol/L的E的浓溶液充分反应,反应后称量剩余锌发现质量减少了65.0g。将反应后的溶液稀释至1L,此时溶液中c(SO42-)= mol/L,产生SO2体积(标准状况下)= L。
(3)当甲是浓氢氧化钠溶液时,B为易液化的气体可作制冷剂
①C是 ,在浓的E溶液中放入过量的铜片,则反应将要结束时的离子方程式为 。
②将盛有D和O2的混合气体12mL的量筒倒立于水槽中,充分反应后,剩余2mL无色气体(均在同温同压下测定),则原混合气体中氧气的体积是 。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;E原子外围电子排布式为 _______
(2)A与B生成D的反应在工业上是生产 的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为 .
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式
在一定条件下可实现下图所示物质之间的转化:
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: 。
(3)写出B电解生成E和D的反应方程式: 。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式 ,该反应消耗了2 molG,则转移的电子数是 。
下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:a.A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。b.反应①②是化工生产中的重要反应。c.化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。d.化合物L具有漂白性,可由Cl2与NaOH溶液反应制得。e.化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)A元素在元素周期表中的位置____________________。
(2)反应③的化学方程式:________________________。
(3)C的结构式:_____ ___;
F的一种用途:_________________________。
(4)L的溶液与化合物E反应的离子方程式:_________ 。
(5)化合物J的化学式: ________________________。
在下图所示的物质转化中,A、C均为常见的金属单质,并且在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见无色液体。L溶液的焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)。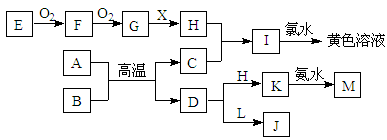
回答以下问题:
(1)H的化学式为 。
(2)L的电子式为 。
(3)A与B反应的化学方程式为 。
(4)K与足量的氨水反应的离子方程式为 。
甲、乙、丙、丁四种物质中,均含有相同的某种元素。在一定条件下它们之间存在如下转化关系:下列说法中错误的是
| A.甲可能是单质,也可能是化合物 | B.丁可能是酸,也可能是碱 |
| C.反应①②一定是氧化还原反应 | D.反应③一定是化合反应 |
(I)阅读下面信息,推断元素,按要求回答问题:
| 信息 |
问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大, 最外层电子数均不少于最内层电子数 |
⑴仅针对信息①,X一定不是 A.氢 B.碳C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH,氧化物的相对式量都大于26 |
⑵这四种元素含有铝元素吗? 。 |
| ③上述四中元素的单质的混合物,加入足量的盐 酸溶液,固体部分溶解,过滤,向滤液中加入过 量的烧碱溶液,最终溶液中有白色沉淀 |
⑶白色沉淀的化学式为 。 |
| ④在W的最价氧化对应的水化合的含氧酸钠盐溶液中,加过量的盐酸能生成白色沉淀。 |
⑷生成白色沉淀的离子方程式为 。 |
| ⑤X与W同主族 |
⑸X的最高价氧化物的电子式为 。 |
(II)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示:
已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3 MnSO4+2NH3↑+CO2↑+H2O。
MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现红色。
(1)写出下列物质的化学式:
A: D: E: N: 。(每空1分)
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: 。
构成A、B、C、D、E五种物质的元素中,只有一种不属于短周期元素。A、B、C、D、E五种物质之间的转化关系如图所示:
下列判断错误的是
A.若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为(NH4)2SO4
B.若A和B都是盐,A难溶于水,而B易溶于水,D不溶于稀硝酸,C为无色无味气体,则B的化学式为NaHSO4
C.若A是2∶1 型的离子化合物,B是硫酸盐,D既可溶于稀盐酸又可溶于NaOH溶液,且A与B的物质的量之比为3∶1时恰好完全反应,则B的化学式为Al2(SO4)3
D.若A是1∶1型的离子化合物,A与过量的B溶液反应才有D生成;将C燃烧的产物通过装有碱石灰的干燥管或盛有浓硫酸的洗气瓶,两者的质量都增加,则B的化学式一定为Al2(SO4)3
已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。
(I)写出A的电子式 。
(II)若反应①除生成甲外还生成丙,写出反应①的化学方程式: 。
(III)若A与丙可以化合生成甲;D与甲的浓溶液加热条件下可以生成三种化合物乙、丙、B,乙、丙、B常温下又可以发生反应④生成甲和另一化合物X。回答下列各小题:
写出反应④的离子方程式 。
在恒容密闭容器中,反应②达到平衡后,测得如下数据(假设不考虑副反应)。
| 实验序号 |
温度℃ |
初始C浓度 (mol·L—1) |
初始丙浓度(mol·L—1) |
C的平衡转化率 |
| 1 |
510 |
0.8 |
1.2 |
A |
| 2 |
510 |
1 |
1.2 |
50% |
| 3 |
500 |
1 |
1.2 |
B |
①此反应在510℃时平衡常数为 。
②实验l中,A的值 ;实验3中,B的值 。(选填序号)
A. 等于50% B.大于50% C.小于50% D.从本题资料,无法判断
③在实验2的平衡体系中,再增加一倍的反应物,平衡将 移动,(填“正向”、“逆向”或“不”)且C的转化率 50%(填“大于”、“小于”或“等于”)
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)F的组成元素在元素周期表中的位置______________。
(2)E与G的稀溶液反应的离子方程式为______________________。
(3)B和C反应的化学方程式为____________________________________。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式______________。
(共6分)常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________;
(2)化合物甲的电子式是_____________________________;
(3)化合物丙中存在的化学键是__________________________。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)组成B单质的元素在周期表中的位置是_________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:___________________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_________________________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
试题篮
()