短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,B是形成化合物种类最多的元素。
请回答下列问题:
(1)描述D在元素周期表中的位置:_____________________
(2)比较A、C、D元素简单离子半径的大小:______>______>______(填微粒符号)
(3)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学反应方程式为_______________________________________________.
(4)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:______________;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:________,写出该阳离子与F氢化物的水溶液反应的离子方程式:__________________________________________________________。
(5)在Fe和Cu 的混合物中加入一定量的C的最高价氧化物的水化物稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后,剩余金属m2g。下列说法正确的是( )
A.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Cu2+
B.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+
C.m1一定大于m2
D.剩余固体m1g中一定有单质铜,剩余固体m2g中一定没有单质铜
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:_________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________________;D中所含化学键的类型为____________________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的相对分子质量相等,请用离子方程式表示F的水溶液呈酸性的原因:_________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是_____________
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是________________。
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_______________________。
已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多, A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液。 其中B1的沸点比B2高。
| ① |
A1 |
B1 |
C1 |
D1 |
| 电子数 |
10 |
10 |
10 |
18 |
| ② |
A2 |
B2 |
C2 |
D2 |
| 电子数 |
10 |
10 |
10 |
18 |
试回答下列问题:
(1)上述两组八种微粒的组成元素中,原子序数处在中间的元素在元素周期表的位置是 ; D1的电子式为: 。
(2)液态的B2与Na反应的方程式: 。
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备方程式 ,其中D1的作用是 ;
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下(已知:I2 + 2S2O32ˉ = S4O62ˉ + 2Iˉ):

步骤一的离子方程式为_______;步骤二的指示剂是______;步骤三中出现________现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为_______。
甲、乙、丙、丁、X是由短周期元素组成的纯净物,其中X为单质。上述物质转化关 系如下图所示(某些产物略去)。
请回答下列问题:
(1)若丁是一元强酸,甲→丁是工业生产丁的主要途径。
①写出反应I的化学方程式: 。
②常温下,1 mol丙发生反应III放出46kJ热量,该反应的热化学方程式为: 。
③在常温下,向V1L pH= 11的甲溶液中加入V2L pH=3的盐酸,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(选填“>”、“<”或“=”),所得溶液中各种离子的浓度由大到小的顺序可能是: (写一种即可)。
(2)若丁是二元弱酸,丙是温室气体。
在容积为2L的容积固定的密闭容器中,将乙(g)和H2O(g)按下表用量分别进行反应:乙(g)+H2O(g)  丙(g) + H2(g),得到如下数据:
丙(g) + H2(g),得到如下数据:
①该反应的正反应为 (填“吸热”或“放热”)反应。
②900℃时,上述反应按如下起始量分别加入该容器:
则此时反应的v(正) v(逆)(填“>”、“<”或“=”)。
③实验3跟实验2相比,改变的条件可能是 。
现有下列11种中学化学常见的物质,在一定条件下可以实现如图所示的转化关系,图中某些反应物和生成物已经略去。

已知:A为两种元素组成的化合物,其焰色反应透过蓝色钴玻璃观察到为紫色;B为单质,是一种有毒气体;反应①的条件是用惰性电极电解;反应②的条件是将E的水溶液加热蒸干、灼烧;Y为常见金属;F中金属元素(+3价)质量分数为70%,C为三核22电子的氧化物。
回答下列问题:
(1)D的电子式为____,H的化学式为 。
(2)反应③的化学方程式为 。过量C通入I溶液中发生反应的离子方程式为 。
(3)指出G的一种用途: 。
(4)将一定量的B通入到含有l mol XBr2的溶液中,若有1/3的Br一被氧化,则通入的B在标准状况下的体积为 L(保留一位小数)。
(5)有同学说:“根据类比推理,三价x的硫酸盐溶液加热蒸干后得到的固体跟物质E加热蒸干后得到的固体是相同的”,这个说法是否正确? (填“正确”或“不正确”),理由是 。
已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中不正确的是
A.A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B.A、B、C中三种元素形成的化合物所属物质类别一定不是碱
C.如果E溶液是一种强酸,则E溶液为盐酸
D.A、B、C中有一种金属且为A
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)④、⑤、⑥简单离子半径由大到小的顺序为_________________________。
(2)⑦、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)由表中①④元素的原子按1:1组成的化合物的稀溶液易被催化分解,通常使用的催化剂为(填序号)____________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)下图中 A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:
I.若B为黄色固体,A为原子半径最小的原子组成的单质,C为双原子分子组成的单质,E能使品红溶液褪色。
①F的电子式为 。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是 。
II.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是 (填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是 。
氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
3 SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
(1)以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2(△H < 0)
4NH3↑+SiH4↑+2MgCl2(△H < 0)
①NH4Cl的化学键类型有____________,SiH4电子式为_______________。
②上述生产硅烷的过程中液氨的作用是________________________。
③氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式_______,实验室可利用如图所示装置完成该反应。 
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是_____________。
(2)三硅酸镁(Mg2Si3O8∙nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________________________。将0.184 g三硅酸镁加到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8∙nH2O的n值为_________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_________________________。
甲与B反应的离子方程式 ___________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是___________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式: ____________________。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明_____________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: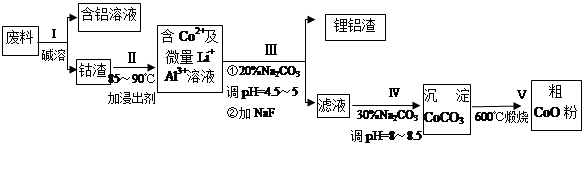
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。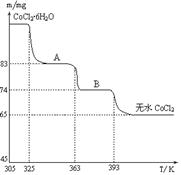
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X |
动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y |
地壳中含量居第一位 |
| Z |
短周期中其原子半径最大 |
| Q |
生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M |
海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值)
可用Q和X的单质在800 ~ 1000℃制得,每生成1 mol QX,吸收a kJ的热量。
可用Q的氧化物、焦炭和X的单质在1600 ~ 1750℃生成QX,每生成1 mol QX,消耗18 g碳,吸收b kJ的热量。
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式________________。
(4)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
短周期元素X、Y、Z原子序数依次递增。X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族。
(1)Z元素在周期表中的位置是 。
(2)Y2ZX3溶液显 性,能证明该溶液中存在水解平衡的事实是 (填序号)。
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):
① D的化学式是 ;
② Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是 。
(4)某温度下,在一个5L的密闭容器中充入0.2 mol ZX2和0.1 mol X2,20 s后达到平衡,测得容器中含有0.18 mol ZX3,则用X2表示该反应的平均速率是v(X2) = ,此温度下该反应的化学平衡常数K= 。
A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,C的单质只有氧化性。
(1)写出实验室制取E2反应的离子方程式_______________________________;
(2)A、C元素按原子个数比为1:1形成化合物的电子式_________________;
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.

①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)________;若装置D中装的是铁粉,当通入E2时D中观察到的现象为____________;若装置D中装的是五氧化二钒,当通入DC2时,打开K通入适量C2,化学反应方程式为________________________________。
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为_______________________________。
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)_________,可以看到白色沉淀生成;
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式______________________________。
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为____________________________。
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为__________mol/L。
物质M是一种日常生活中不可缺少的调味品。已知C在D中燃烧发生苍白色火焰,M与其他物质的转化关系如图甲所示(部分产物已略去);
(1)写出用惰性电极电解M溶液的离子方程式___________________________________。
(2)比较B中各元素原子半径大小__________(填元素符号)。
(3)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是______________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________________________。
(5)若A是一种溶液,只可能含有H+,NH4+,Mg2+,Fe3+,Al3+,CO32-,SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图乙所示.由此可知,该溶液中肯定含有的离子及其浓度之比为___________________________。
(6)若E可用于检验葡萄糖的存在,写出G溶液充分蒸发灼烧后的产物与乙醇反应的化学方程式________。
(7)根据右图,写出25℃时由CO2和H2O转化为葡萄糖溶液的化学方程式______________________。
试题篮
()