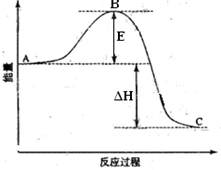
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。
(l)图中所示反应是______(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H=_______(用含 、
、 的代数式表示)。
的代数式表示)。
(2)已知热化学方程式:H2(g) + O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_____________。
原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,盛 的试管中气体产生较快,盛 的试管中气球变得更大;
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3—(aq)+ H+(aq) ="===" H2O(l)+ CO2(g) △H>0
CO32—(aq)+ 2H+(aq) ="===" H2O(l)+ CO2(g) △H<0
甲下结论的方法是否正确 (填“正确”或“不正确”)
(3)为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 |
试剂1 |
试剂2 |
混合 前温度 |
混合后最高 或最低温度 |
| ① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
| ② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
| ③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
| ④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
| ⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
| ⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
通过上述实验可得出五条结论
a:NaHCO3的溶解是 (吸热或放热)过程;
b:Na2CO3的溶解是 (吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
e:NaHCO3固体与稀盐酸反应的反应热是由 (填a→d的字母)的热效应之和。
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(DH),化学反应的DH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol−1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1) 比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2) 右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的 顶点用“●”表示出与之紧邻的硅原子。
(3) 工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热DH=
Si(s)+4HCl(g),该反应的反应热DH=
kJ/mol
A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)写出E元素的名称: E________
(2)画出C原子的原子结构示意图 ,写出AB2的结构式
(3)写出DB2使澄清石灰水变浑浊的化学方程式:_____________________
(4)写出E的单质与NaOH溶液反应的离子方程式:________________________________________
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。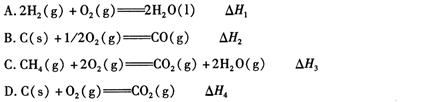
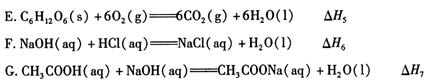
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。

反应过程的能量变化如图所示。已知1
氧化为1
的
.请回答下列问题:
(1)图中点表示。
的大小对该反应的反应热有无影响。该反应通常用
作催化剂,加
会使图中
点升高还是降低,理由是;
(2)图中=
;
(3)的催化循环机理可能为:
氧化
时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
,。
2SO2(g)+ O2(g) 2SO3(g) △H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
⑴图中A点表示__________________,a=__________。
⑵Ea的大小对该反应的△H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
⑶已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:_____________________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为___ _。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。
根据上述数据可计算:N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
2SO2(g)+O2 (g)= 2SO3 (g),反应过程的能量变化如图所示。已知:1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ/mol。
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中ΔH= kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)= mol/(L·min);
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。
.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化。
(1)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为________kJ·mol-1,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH。
C(石墨)+O2(g)===CO2(g)ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599.2kJ·mol-1,
则由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH=________kJ·mol-1。
②已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出XkJ热量。已知单质碳的燃烧热为YkJ·mol-1,则1molC与O2反应生成CO的反应热ΔH为________。
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_______________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。
反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是__________________________________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
C.根据②推知反应:CH3OH(l)+ O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②的能量变化如图所示 |
化学反应中既有物质变化,又有能量变化,释放或吸收热量是化学反应中能量变化的主要形式之一。已知C(石墨)、H2(g)燃烧的热化学方程式分别为:
① C(石墨)+ O2(g)=CO(g)
O2(g)=CO(g)  ="-111.0" KJ·mol-1
="-111.0" KJ·mol-1
② H2(g)+  O2(g) =H20(g)
O2(g) =H20(g)  ="-242.0" kJ·mol-1
="-242.0" kJ·mol-1
③ C(石墨)+O2(g)=CO2(g)  ="-394.0" kJ·mol-1
="-394.0" kJ·mol-1
请解答下列问题:
(1)化学反应中有能量变化的本质原因是反应过程中有 的断裂和形成。上述三个反应都是 (填“吸热”或“放热”)反应。
(2)在热化学方程式中,需要标明反应物及生成物的状态的原因是 ;在①中,02的化学计量数“1/2”是表示 (填字母)。
a.分子个数 b.物质的量 c.气体的体积
(3)反应2H20(g)=2H2(g)+02(g)的 = KJ·mol-1。
= KJ·mol-1。
(4)若C(金刚石)+02(g)=C02(g)的 ="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
(5)已知形成H20(g)中的2 mol H-O键能放出926.0 kJ的能量,形成1 mol 02(g)中的共价键能放出498.0 kJ的能量,则断裂1 mol H2(g)中的H-H键需要的能量 KJ。
(6)工业制氢气的一个重要途径是用CO(g)与H2O(g)反应生成C02(g)和H2(g),则该反应的热化学方程式是 。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H =
在量热计中(如图)将100 mL 0.50 mol/L的CH3COOH溶液与100 mL 0.55 mol/L NaOH溶液混合,温度从298.0 K升高到300.7 K.已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J/K,溶液密度均为1 g/mL,生成溶液的比热容c=4.184 J/(g·K).
(2) CH3COOH的中和热ΔH=_______________________________.
(3)CH3COOH的中和热的文献值为-56.1 kJ/mol,你认为(1)中测得的实验值偏差可能的原因是(填二点)____________________________________________
试题篮
()