下列说法不正确的是( )
| A.σ键比π键重叠程度大,形成的共价键强 |
| B.两个原子之间形成共价键时,最多有一个σ键 |
| C.气体单质中,一定有σ键,可能有π键 |
| D.N2分子中有一个σ键,2个π键 |
下列说法不正确的是
| A.发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 |
| B.物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 |
| C.氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 |
| D.农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
下列关于化学键的说法,正确的是
| A.化合物中一定没有非极性键 |
| B.单质中不可能含有离子键 |
| C.金属元素与非金属元素间形成的键均是离子键 |
| D.CO2、CH4分子中每个原子最外层均形成了8电子结构 |
下列过程中,破坏的作用力相同的是
| A.干冰升华和碘升华 | B.HCl溶于水和NaCl溶于水 |
| C.石英熔化和冰熔化 | D.NH4Cl受热分解和HI受热分解 |
下列说法正确的是
A.分子内共价键越强,分子越稳定,其熔沸点也越高
B.C、H、O、N四种元素组成的化合物一定是离子化合物
C.HF分子间存在着氢键,所以HF比HCl稳定
D.由原子构成的晶体可能是原子晶体,也可能是分子晶体
下列说法正确的是
A.质子数为6,中子数为7的原子的元素符号可表示为 |
| B.H2、SO2、CO三种气体都可用浓硫酸干燥 |
| C.共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏 |
| D.陶瓷、玻璃、水泥、大理石的主要成分都是硅酸盐 |
下列有关作用力的说法正确的是( )
| A.金属键、离子键、分子间作用力、氢键都没有方向性和饱和性 |
| B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱 |
| C.离子键、金属键、氢键、范德华力本质上都是静电作用 |
| D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键 |
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如右图所示的实验,发现烧杯中溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是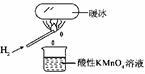
A水凝固形成20~C时的“暖冰”所发生的变化是化学变化
B.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
下列叙述正确的是
①任何化学反应都有反应热 ②化合物MgO、SiO2、Al2O3中化学键的类型相同 ③有些化学键断裂时吸收能量,有些化学键断裂时放出能量 ④PH3分子稳定性和沸点均低于NH3分子 ⑤O3和NO2都是共价化合物 ⑥有热量变化的过程一定有化学键的断裂与形成 ⑦单质中不可能有离子键 ⑧有化学键断裂的变化属于化学变化
| A.①④⑦ | B.②③ | C.③⑤ | D.②⑤⑥ |
下列观点正确的是 ( )
| A.化合物电离时,生成的阴离子是氢氧根离子的是碱 |
| B.某化合物的熔融状态能导电,该化合物中一定有离子键 |
| C.某化合物的水溶液能导电,该化合物一定是电解质 |
| D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 |
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
| A.K3C60中只有离子键 | B.K3C60中不含共价键 |
| C.该晶体在熔融状态下能导电 | D.C60与12C互为同素异形体 |
下列物质中含有相同的化学键类型的是
| A.NaCl、HCl、H2O、NaOH | B.Cl2、Na2S、HCl、SO2 |
| C.HBr、CO2、H2O、CS2 | D.Na2O2、H2O2、H2O、O3 |
下列说法正确的是
| A.分子内共价键越强,分子越稳定,其熔、沸点也越高 |
| B.共价化合物溶于水,分子内共价键一定被破坏 |
| C.离子键的形成一定有电子的得与失 |
| D.分子晶体中一定存在分子间作用力,不一定存在共价键 |
试题篮
()