下列说法正确的是
| A.中和物质的量浓度和体积均相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等 |
| B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则b一定大于a |
| C.25℃,pH均等于5的NaHSO4和NH4Cl水溶液中,水电离出c(H+)均为10-5mol·L-1 |
| D.c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),只能满足NaHCO3溶液中的离子浓度关系。 |
0.1mol·L-1CH3COOH溶液中加水或加入少量CH3COONa晶体时,都会引起的变化的是:
| A.溶液的pH增大 | B.CH3COOH的电离程度变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
酸碱完全中和时
| A.酸和碱的物质的量一定相等 |
B.酸所提供的H+与碱提供的 的物质的量相等 的物质的量相等 |
| C.酸和碱的物质的量浓度相等 |
| D.溶液一定呈中性 |
某盐的混合物中含有0.2 mol Na+、0.4 mol Mg2+、0.4 mol Cl -,则SO42- 为( )
| A.0.1 mol | B.0.3 mol | C.0.5 mol | D.0.15 mol |
下列说法中,正确的是( )
| A.在溶液中,H+、NO3-、Fe2+、Na+一定不能大量共存 |
| B.化学反应过程中,一定有物质的变化,不一定有能量的变化 |
| C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ + Cu=Fe2+ + Cu2+ |
| D.向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀 |
在下列溶液中Cl-离子的物质的量浓度最大的是
| A.0.5L 0.1mol/L的NaCl溶液 | B.100mL 0.2mol/L的MgCl2溶液 |
| C.1L 0.2mol/L的AlCl3溶液 | D.1L 0.3mol/L盐酸溶液 |
下列对化学反应的表示正确的是( )
A.用铜作电极电解硫酸铜溶液的离子方程式:2Cu2++2H2O 4H++2Cu+O2↑ 4H++2Cu+O2↑ |
| B.含氢氧化钠20.0 g的稀溶液与足量盐酸反应放出28.7 kJ的热量,热化学方程式:NaOH(aq)+ HCl(aq)====NaCl(aq)+H2O(l)ΔH="-28.7" kJ·mol-1 |
C.碳酸氢钙溶液中加入过量饱和氢氧化钙溶液的离子方程式:Ca2++ +OH-====CaCO3↓+H2O +OH-====CaCO3↓+H2O |
D.稀硝酸与过量铁粉反应的离子方程式:3Fe+8H++2 ====3Fe3++2NO↑+4H2O ====3Fe3++2NO↑+4H2O |
下列叙述正确的是
| A.可用于电动汽车的铝-空气燃料电池,通常用NaOH溶液做电解液,其正极反应为:O2+2H2O+4e-===4OH- |
| B.常温下,PH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度均为1×10-9 mol·L-1 |
| C.溴化钠溶液中加入少量新制氯水充分反应后,再加入少量苯振荡静置后上层颜色变浅,下层颜色变为橙红色 |
| D.导电、缓慢氧化、品红褪色和久置浓硝酸变黄都一定属于化学变化 |
升高温度,下列常数中不一定增大的是
| A.平衡常数K | B.电离常数Ka |
| C.水的离子积常数Kw | D.盐的水解常数Kh |
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: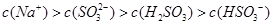 |
B.已知NaHSO3溶液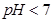 ,该溶液中: ,该溶液中: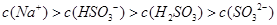 |
C.当吸收液呈中性时: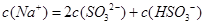 |
D.当吸收液呈酸性时: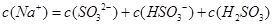 |
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如右下图所示(不考虑挥发)。下列说法正确的是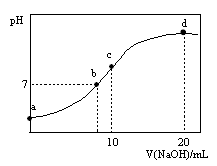
A.点a所示溶液中:c(NH )>c(SO )>c(SO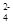 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.点b所示溶液中:c(NH )=c(Na+)>c(H+)=c(OH-) )=c(Na+)>c(H+)=c(OH-) |
C.点c所示溶液中:c(SO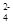 )+ c(H+)= c(NH3·H2O )+ c(OH-) )+ c(H+)= c(NH3·H2O )+ c(OH-) |
D.点d所示溶液中:c(SO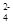 )>c(NH3·H2O )>c(OH-)>c(NH )>c(NH3·H2O )>c(OH-)>c(NH ) ) |
下列变化规律不正确的是 ( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
下列溶液中Cl-浓度最大的是( )
| A.10mL 0.2mol/L的FeCl3溶液 | B.30mL 0.25mol/L的FeCl2溶液 |
| C.20mL 0.2mol/L的KCl溶液 | D.10mL 0.3mol/L的AlCl3溶液 |
试题篮
()