室温下,下列叙述正确的是(溶液体积变化忽略不计)
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.①、④两溶液等体积混合,所得溶液中c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+)
D.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
下列叙述错误的是
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液  混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) 混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) |
| B.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba+)>c (Na+)> c (H+) |
| C.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
| D.向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 |
下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 |
| C.在c(H+)∶c(OH-)=1∶1012的溶液中,Na+、I-、NO3-、SO42-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是 (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③﹝填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)。
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸的化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
(10分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸______(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式______________。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈___________(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)_____________________。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为____________(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为__________。
a.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) b.c(Na+) = c(CH3COO-)>c(OH-) =c(H+)
c.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) d.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(2)向盛有1mL 0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是_____________________________,
产生该现象的原因是(用离子方程式或文字表示)_______________________________。
下列说法正确的是
| A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色 |
| B.Al3+、NO3—、Cl-、CO32—、Na+可大量共存于pH=2的溶液中 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大 增大 |
下列叙述正确的是:
| A.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
硫酸盐有着广泛的应用。
(1)以下是CuSO4·5H2O的实验室制备流程图。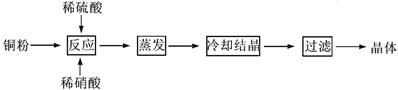
根据题意完成下列填空:
① 理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为 ,发生反应的离子方程式为 。
② 实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是 。请在下图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。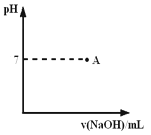
③用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢 复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为
(2)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为: mol.
(用含m、n的代数式表示)。
(3)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是
①醋酸铅可溶于水 ②醋酸铅是弱电解质
③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
⑤因醋酸是弱酸,故反应可进行
(共10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。依照该规律,请判断下列反应不能成立的是______(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HClO B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa→NaHCO3+C6H5OH D.CO2 +H2O +2C6H5ONa→Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值约为_______(填数值)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液;②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
请根据上述反应,总结出复分解反应发生的另一规律 。根据这结论,现将Na2S和AgI固体混合搅拌,则反应的离子方程式 。
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol•L-1时通常认为该离子沉淀完全)。
| 金属离子 |
Ksp |
pH(10-1 mol•L-1) |
pH(10-5 mol•L-1) |
| Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
| Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
| Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
| Ca2+ |
4.0×10-5 |
12.3 |
14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol•L-1。为除去其中的Fe3+,回收铜,需控制的pH范围是_______________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为______________________。
②pH对废水中Cr2O72-去除率的影响如图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:_________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,式中:co—处理前废水中Cr2O72-浓度,c—处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaSO4)=9.1x10-6,Ksp (CaCO3)=2.8×10-9]
。A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
①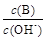 ; ②
; ② 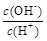 ;
;
③c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号) 。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
醋酸溶液中存在电离平衡:CH3COOH(aq) H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
根据上述电离常数分析,下列表述不正确的是( )
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
C.2 NaCN + H2O + CO2 =2 HCN + Na2CO 3
D.2CH3COOH + Na2CO3 → 2 CH3COONa + H2O + CO2 ↑
试题篮
()