(1)下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(2)25℃,柠檬水的pH是3,其中c(OH?)= 。
(3)25 ℃,有pH=12的氢氧化钠溶液100ml,要使它的pH降为11。应加蒸馏水的体积为 ml;若加pH=10的氢氧化钠溶液,应加 ml。
(4)25 ℃,pH=3盐酸和pH=11氨水等体积混合后溶液呈 性。(选填“酸”、“中”或“碱”)
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
(1)写出醋酸的电离方程式_______________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是 。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲__ 10C(H+)乙(填“大于”、“小于”或 “等于”)甲,其原因是: 。
(4分)已知25 ℃时,0.1 mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的____________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 | C.气体NH3 | D.固体NaHCO3 |
(2)若乙的解释正确,溶液的pH应__________(填“增大”“减小”或“不变”)。(已知25 ℃时,NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5)
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl⑤(NH4)2CO3的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中
c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_____________________________________________。
已知Ksp(BaA)=1.8×10-10,向该混合溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。
(3)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为____(填“大于”“等于”“小于”或“均有可能”)。
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
| 酸或碱 |
电离常数(Ka或Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
表1
| 难(微)溶物 |
溶度积常数(Ksp) |
| BaSO4 |
1×10-10 |
| BaCO3 |
2.6×10-9 |
| CaSO4 |
7×10-5 |
| CaCO3 |
5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最强的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”),溶液中各离子浓度大小的关系是 。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0。0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种:还原沉淀法和电解法。还原沉淀法的工艺流程为:其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O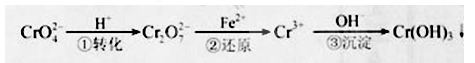
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) 。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)25℃时,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),① 和 两种粒子的物质的量之和等于0.1mol。 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前 c (HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O).
混合后溶液中与c(NH4+) c(Cl-)。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较强的物质。依照该规律,请判断下列反应不能成立的是 (填字母序号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CO2+H2O+NaClO===NaHCO3+HClO
C.CH3COOH+NaOH===CH3COONa+HCN
(2)根据上述信息判断,常温下浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是 (填序号),其pH为 (填数值);pH最大的是 (填序号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)已知溶液积常数:KSP(AgI)=9.3×10-17,KSP(AgCl)=1.8×10-10,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,其离子反应方程式为 。
运用相关原理,回答下列各小 题:
题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO4 2-。
2-。
(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填“>”、“=”或“< ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(2)将 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O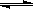 H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH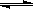
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)
 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1
在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14、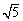 =2.2)
=2.2)
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.
(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g) 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A. + + =1 =1 |
B.2 = = |
C.a+b=14.9 | D.c1=c2=c3 |

(12分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________ _;
(3)写出0.1 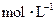 的
的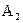 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ________________;
(5)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题 意回答下列问题:
意回答下列问题:
(1)写出酸H2A的电离方程式 。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为 。
(3)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为______ ______。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
试题篮
()