在一定温度下的定容密闭容器中,反应:A(s)+2B(g) C(g)+D(g)达到平衡的标志是( )
C(g)+D(g)达到平衡的标志是( )
A.混合气体的压强 B.单位时间生成2n mol的B同时消耗n mol的D
C.混合气体的密度 D.A、B、C、D物质的量之比为1:2:1:1
某温度下在密闭容器中发生如下反应:2M(g)+ N(g)  2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
| A.20% | B.40% | C.60% | D.80% |
一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是 ( )
2AB(g)达到平衡状态的标志是 ( )
A.2υ(正、A2)=υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是
| A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
| B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
| C.t=c时反应处平衡状态 |
| D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
金属卤化物跟卤素化合可生成多卤化物,如:KI+I2 KI3,有关KI3的叙述中不正确的是
KI3,有关KI3的叙述中不正确的是
| A.I2在KI溶液中溶解度增大是由于生成I3-离子 |
B.I3-在溶液中存在下列平衡I3- I2+I- I2+I- |
| C.KI3溶液遇淀粉不变蓝色 |
| D.将Cl2通入KI3溶液中,I3-浓度减小 |
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)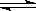 2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
| |
恒容容器甲 |
恒压容器乙 |
| Y的物质的量/mol |
n1 |
n2 |
| Z的体积分数 |
φ1 |
φ2 |
A.平衡时容器乙的容积一定比反应前大
B.平衡时容器甲的压强一定比反应前大
C.n2>n1
D.φ2>φ1
反应2X(?)+Y(g) 2Z(g) △H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
2Z(g) △H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是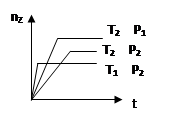
| A.△H>0,X为气体 | B.△H>0,X为固体 |
| C.△H<0,X为气体 | D.△H<0,X为固体 |
对于已达到平衡状态的可逆反应:A+B C+D,若t1时增大压强,正、逆反应速率变化如图所示,下列有关A、B、C、D四种物质的状态叙述中正确的是( )
C+D,若t1时增大压强,正、逆反应速率变化如图所示,下列有关A、B、C、D四种物质的状态叙述中正确的是( )

A.A、B、C、D一定都是气体
B.A、B一定都是气体,C、D只有一种是气体
C.C、D一定都是气体,A、B只有一种是气体
D.C、D至少有一种是气体,A、B也至少有一种是气体
将0.5 mol SO2和0.2 mol O2置于密闭容器中发生反应:2SO2+O2 2SO3。下列关于该反应的说法正确的是
2SO3。下列关于该反应的说法正确的是
| A.最终可生成0.4 mol SO3 | B.当v正(O2)= v逆(SO2) = 0时一定达化学平衡 |
| C.升高温度反应速率减小 | D.缩小体积增大压强反应速率增大 |
某温度下,恒容密闭容器中发生如下可逆反应:2 E(g)  F(g) + x G(g)(正反应放热);若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5amol/L,若E的起始浓度改为2amol/L,F、G 浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g) + x G(g)(正反应放热);若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5amol/L,若E的起始浓度改为2amol/L,F、G 浓度仍为0,当达到新的平衡时,下列说法正确的是( )
| A.升高温度时,正反应速率加快,逆反应速率减慢,平衡逆向移动 |
| B.若x=1,新平衡下E转化率为50% |
| C.若x=2,新平衡下F的平衡浓度为0.5a mol/L |
| D.若x=2,换成恒压容器,则达到平衡所需时间比恒容容器所需时间短 |
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
|
0.4 |
| 15 |
0.8 |
|
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1·min−1
B.保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
某一反应物在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为
| A.大于25.3% | B.小于25.3% | C.等于25.3% | D.不能确定 |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
试题篮
()