现向一密闭容器中充入1 mol N2和 3 mol H2,在一定条件下开始反应。下列有关说法中正确的是( )
| A.达到化学平衡时,将生成2 mol NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是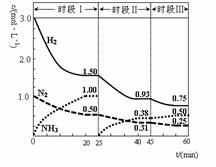
| A.前20分钟反应内放出的热量为46.2kJ |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
反应2X(g)+Y(g) 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
| A.T1<T2,P1<P2 | B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 | D.T1>T2,P1<P2 |
下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有平衡:Br2+ H2O  HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
B.对CO(g) + NO2 (g) CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 |
| C.升高温度能够增大硝酸钾在水中的溶解度 |
| D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下可逆反应:2A(g) + B(g) 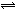 2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
A.反应达到平衡时,A、B、C的浓度不再变化,反应停止
B.升高温度、增大压强、增加A的浓度、减小C的浓度或使用催化剂等都可以使反应速率加快
C.经过足够长时间后,A和B可以完全转化为C
D.2s时物质A转化了1.2mol
可逆反应N2(g)+3H2(g) 2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol N2的同时,生成3n mol H2
②断开1mol H-H键的同时断开2 molN-H键
③用N2、H2、NH3的浓度变化表示的反应速率之比为1:3:2
④混合气体的压强不再改变
⑤混合气体的密度不再改变
| A.②④ | B.①④ | C.①③④ | D.②③④⑤ |
有一处于平衡状态的反应:X(s)+3Y(g) 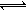 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ;△H=-92.4kJ/mol。
2NH3(g) ;△H=-92.4kJ/mol。
N2的平衡转化率(α)与体系总压强(P)的关系如右图所示。下列说法正确的是:
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B. 平衡状态由A变到B时,平衡常数K(A) < K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 保持压强不变,通入惰性气体,平衡常数不变,平衡不移动
对于可逆反应:m A(g) + n B(g) x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是
x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是 
| A.△H > 0, m + n > x | B.△H > 0, m + n < x |
| C.△H < 0, m + n < x | D.△H < 0, m + n > x |
一定温度下,对可逆反应A(g)+2B(g)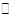 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是
A.单位时间内消耗a mol A,同时生成3a mol C
B.当3v(B)正="2" v(C)逆
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示。下列说法正确的是( )
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示。下列说法正确的是( )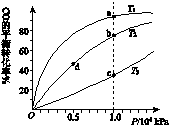
下列说法正确的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度不都能加快O2的生成速率 |
在一定条件下,使10molSO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)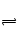 2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)
2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)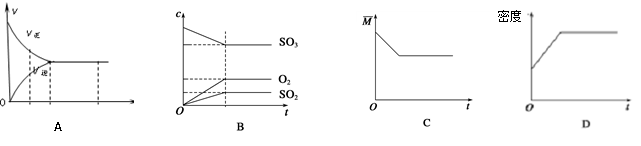
可逆反应:2NO2(g) 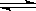 2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2 ② 单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤ 混合气体的密度不再改变的状态
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2 ② 单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤ 混合气体的密度不再改变的状态
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
试题篮
()