下列有关颜色变化错误的是
| A.在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 |
| B.在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 |
| C.向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 |
| D.用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色先变深后变浅 |
某反应的平衡常数表达式为 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K= 
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
在一定条件下,恒容的密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
| A.C(SO3)=0.4mol·L-1 | B.C(SO3)+C(SO2)=0.15 mol·L-1 |
| C.C(O2)=0.3mol·L-1 | D.C(SO3)+C(SO2)=0.4 mol·L-1 |
在体积不变的密闭容器中按一定比例通入氮气和氢气,反应合成氨气,该反应放热。欲加快反应的速率同时提高合成氨中H2的转化率,下列措施可行的是( )
| A.升高温度 | B.适当增大压强 | C.加入催化剂 | D.从容器中分离出氨 |
下列事实,不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D.实验室用排饱和食盐水而不用排水法收集氯气 |
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)  (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
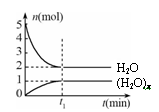
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125 L2/mol2 |
| C.平衡时混合气体的平均摩尔质量是30 |
| D.t1时刻,保持温度不变,再充入1 molH2O(g), |
重新达到平衡时,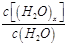
 将增大
将增大
25℃时,水的电离达到平衡:H2O H++OH―;ΔH>0,下列叙述正确的是
H++OH―;ΔH>0,下列叙述正确的是
| A.向水中加人稀氨水,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间内生成n mol A2,同时生成n mol AB |
| B.容器内总压强不随时间改变 |
| C.任何时间内A2、B2的物质的量之比为定值 |
| D.单位时间内生成2n mol AB同时生成n mol B2 |
臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是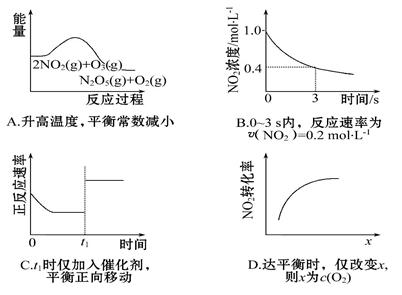
在一定温度下的定容密闭容器中,表明反应:A(g)+2B(g)  C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
A. A、C、D的物质的量浓度相等 B. 混合气体的密度不再改变
C. 气体的总物质的量不再改变 D. v(B) = 2v(C)
试题篮
()