下列图示与对应的叙述相符的是
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) |
| C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大 |
下列说法正确的是( )
| A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
| B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
| C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 |
D.一定条件下反应N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
反应A(g)+ B(g)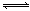 C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
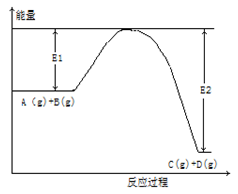
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
一定温度下,某气体反应达到化学平衡,平衡常数K=c(A)•c2(B)/ c2(E) •c(F),恒容时,若温度适当降低,则F的浓度增加,下列说法中正确的是
A.降低温度,正反应速率减小、逆反应速率增大
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s) A(g)+2B(g)
A(g)+2B(g)
D.该反应的焓变△H>0
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )

A.2SO2(g)+O2(g) 2SO3(g);△H<0 2SO3(g);△H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0 4NO(g)+6H2O(g);△H<0 |
C.H2(g)+I2(g) 2HI(g);△H>0 2HI(g);△H>0 |
D.N2(g) +3H2(g) 2NH3(g);△H<0 2NH3(g);△H<0 |
在恒温恒容的密闭容器中,反应A(g)+B(s) 2C(g)达到化学平衡状态的是
2C(g)达到化学平衡状态的是
| A.消耗1molA的同时消耗1mol B |
| B.消耗n molA,同时生成2nmolC |
| C.气体的总体积不变 |
| D.容器内气体密度不变 |
下列事实不能用勒夏特列原理解释的是
| A.光照新制的氯水时,溶液的pH逐渐减小 |
B.高温高压有利于N2和H2转化为NH3(N2(g)+3H2(g) 2NH3(g);△H<0) 2NH3(g);△H<0) |
| C.打开汽水瓶时,有大量气泡逸出 |
| D.氨水应密闭保存于低温处 |
材料是人类赖以生存和发展的重要物质基础,铁和碳是生活中常见的材料。
(1)碳可用于制取水煤气:C(s)+H2O(g)=CO(g)+H2(g)。相同温度下,在体积均为2L的两个密闭容器(已加入足量的碳)中进行上述反应,反应容器分别用编号A、B表示。
①写出该反应的平衡常数的表达式:
②已知该温度下平衡常数K="1.5" mol·L-1,若向A容器中另加入一定量的水蒸气,经过一段时间后达到平衡,此时c(H2O)=0.1mol·L-1、c(CO)=0.5mol·L-1,则c(H2)= mol·L-1。
③若向B容器中再加入一定量的水蒸气,某一时刻测得体系中物质的量如下:n(H2O)=0.2mol、n(CO)=0.2mol、 n(H2)=0.8mol则此时该反应
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(2)钢铁在海水中常发生电化学腐蚀,其负极反应式为 ;
(3)利用右图装置,可以模拟铁的电化学防护,为减缓铁的腐蚀,若开关K置于b处则Fe应与电源的 极相连。若开关置于a处,则下列可用作X极材料的是 。
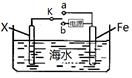
A.Zn B.Cu C.石墨 D.Pt
某温度时,N2(g)+3H2(g) 2NH3(g)的平衡常数K=a, 则此温度下,
2NH3(g)的平衡常数K=a, 则此温度下,
NH3(g) 
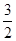 H2(g)+
H2(g)+ N2(g)的平衡常数为
N2(g)的平衡常数为
| A.aˉ½ | B. a a |
C.a½ | D.aˉ2 |
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=______________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=___________。
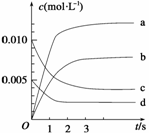
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
t°C时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下该反应的平衡常数表达式为: ,有关该平衡体系的说法正确的( )
,有关该平衡体系的说法正确的( )
| A.升高温度,平衡常数K一定增大 |
| B.增大压强,W(g)质量分数增加 |
C.该反应的化学反应方程式为X+2Y  2Z+2W 2Z+2W |
| D.增大X(g)浓度,平衡向逆反应方向移动 |
关于化学平衡常数K,下列说法不正确的是 ( )
| A.K只随温度的改变而改变 |
| B.K>Q(Q为浓度熵)平衡正向移动 |
| C.正、逆反应的平衡常数数值相同,符号相反 |
| D.K值变化平衡一定发生移动 |
试题篮
()