(15分)最近科学家提出“绿色自由”构想:把含有大量CO2的空气吹入碳酸钾溶液中,再把CO2从溶液中提取出来,并使之与氢气反应生成可再生能源甲醇。其工艺流程如图所示: 
(1)写出分解池中反应的化学方程式为_______________;
(2)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出4947kJ的热量,试写出该反应的热化学方程式_______________;
(3)已知合成塔中的反应是可逆的,根据平衡移动原理,低温有利于原料气的转化,而实际生产中采用300℃的温度,其原因可能是_______________;
(4)“绿色自由”构想流程中常包括物质的“循环利用”,上述流程中能体现“循环利用”的物质除碳酸钾溶液外,还包括________(化学式)。
(5)300℃时,将CO和H2按1:3的体积比充入密闭容器中,CO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再达平衡是,与原平衡比较下列说法正确的是________。
| A.CO2的浓度减小 |
| B.正反应速率增大,逆反应速率减小 |
| C.CO2和H2的体积比为1:3 |
| D.CH3OH的体积分数增大 |
②将1.0molCO2和3.0molH2置于体积不变的密闭容器中,2min时反应达到平衡,此时体系总压强为0.10MPa,用H2表示的反应速率为1.2mol/(L·min),则密闭容器的体积是____L。
(6)甲醇可制作燃料电池。以氢氧化钾溶液为电解质的负极反应式是__________。当转移的电子的物质的量为_______mol时,参加反应的氧气的体积是6.72L(标准状况下)。
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)⇌PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
| A.反应在前50s的平均速率v(PCl3)=0.0032mol•L-1•s-1 |
| B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
| D.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆) |
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 |
450 |
500 |
550 |
600 |
| SO2的转化率% |
97.5 |
95.8 |
90.50 |
80.0 |
(1)由表中数据判断△H 0(填“>”、“=”或“<”)
(2)能判断该反应是否达到平衡状态的是
A 容器的压强不变 B 混合气体的密度不变
C 混合气体中SO3的浓度不变 D C(SO2)=C(SO3)
E V正(SO2)=V正(SO3) F V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1.
①0~2min之间,O2的反应速率为 .
②此时的温度为 ℃.
③此温度下的平衡常数为 (可用分数表示).
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将 向移动.
甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )

| A.脱氢反应的△H<0 |
| B.在t1K时,该反应的平衡常数为8.1 |
| C.600K时,Y点甲醇的υ(正) <υ(逆) |
| D.若增大体系压强,曲线将向上平移 |
减少污染、保护环境是全世界最热门的课题。
I.CO在催化剂作用下可以与H2反应生成甲醇:
①CO(g)+2H2(g)  CH3OH(g),△H1
CH3OH(g),△H1
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 |
H-H |
C-O |
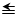 C O C O |
H-O |
C-H |
| E/(kJ·mol-1) |
436 |
343 |
876 |
465 |
413 |
由此计算△H1= 。
(2)图1中能正确反映反应①平衡常数的对数lgK随反应温度T的变化曲线为 (填曲线标记字母),其判断理由是 。

(3)在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图2。
①P1 P2(填“大于”或“小于”),其判断理由是 。
②M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为 。
③M、N、Q三点平衡常数KM、KN、KQ大小关系为 。
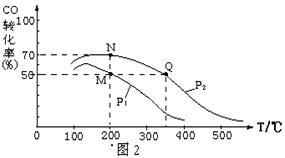
II.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示。已知:气体分压(P分)= 气体总压(P总)× 体积分数。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示。已知:气体分压(P分)= 气体总压(P总)× 体积分数。
完成下列填空:
①650℃时,反应达平衡后CO2的转化率为 。
②T℃时,若充入等体积的CO2和CO,平衡 (填“向左移动”、“向右移动”或“不移动”)
③925℃时,P总=1/96MPa,用平衡分压代替平衡浓度表示的化学平衡常数KP= 。
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:

(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:

由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为 ;
②乙苯的平衡转化率为 ;
③计算此温度下该反应的平衡常数 。
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(3)已知:

计算上述反应的ΔH= kJ/mol。
当前我国环境状况不容乐观,其中PM2.5、CO、S02、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义。
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样中的化学组分及其平均浓度如下表:

根据表中数据计算该试样的pH=
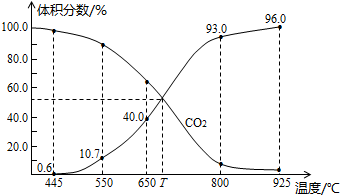
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图1所示。
①写出N2和02反应的热化学方程式:________。
②有人设想将C0按下列反应除去:2CO(g)= 2C(s)+02(g)△H>O,请你分析该设想能否实现? (填“是”或“否”),依据是
③用图2所示原电池原理也可以除去CO,则其负极反应式为:________。
(3)有人设想利用反应NaOH+S02=NaHS03将SO2吸收除去,然后用石灰水又可使NaOH再生。再生的离子方程式为: 。
(4)利用I205消除CO污染的反应为:5CO(g)+I205(s)—兰5CO2(g)+I2(s),不同温度下,测得CO2的体积分数随时间t变化曲线如图3.则:
①该反应的化学平衡常数表达式为K=____ 。
②T1与T2化学平衡常数大小关系:K(T1)__________K(T2)(填“>”、“<”或“=”)
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。工业制硫酸的过程中,SO2催化氧化的原理:
2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
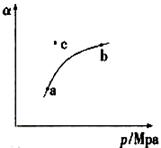
(1)某温度下,测得SO2(g)的平衡转化率(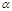 )与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
)与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是
| A.温度: T1>T2>T3 |
| B.正反应速率:υ(b)>υ(d) υ(a)>υ(c) |
| C.平衡常数:K(a)>K(c) K(b)=K(d) |
| D.平均摩尔质量: M(b)>M(d) M(a)<M(c) |
下列说法不正确的是
| A.一定温度下,在固定体积的密闭容器中发生可逆反应A(s)+B(g)═C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 |
| B.对于反应C(s)+CO2(g)═2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 |
C.常温下向0.1mol•L﹣1的NH3•H2O中加入氯化铵固体,则溶液中 减小 减小 |
D.常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液,溶液中 不变 不变 |
某温度下,碳和H2O(g)在密闭容器里发生下列反应:①C(s)+H2O(g) CO(g)+H2(g),②CO(g)+H2O(g)
CO(g)+H2(g),②CO(g)+H2O(g) CO2(g)+H2(g)反应达到平衡时,c(H2)=1.9mol•L﹣1、c(CO)=0.1mol•L﹣1.则下列叙述正确的是
CO2(g)+H2(g)反应达到平衡时,c(H2)=1.9mol•L﹣1、c(CO)=0.1mol•L﹣1.则下列叙述正确的是
| A.CO在平衡时转化率为10% |
| B.平衡浓度c(CO2)=c(H2) |
| C.其他条件不变时,缩小体积,反应②平衡不移动 |
| D.平衡时增大碳的质量,反应①中热量值不变 |
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:

① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 温度升高,该反应的平衡常数K (填“增大”、“减小”或“不变”)
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)右图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)。

该图中的实线与虚线部分是什么反应条件发生了变化? 。
(2)在一定温度下,若将4amol H2和2amol N2放入VL的定容密闭容器中,2分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为 摩尔/(升–秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (填“正向移动”“逆向移动”或“不移动”)。
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒物质的量大小排列为:
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是 。
a.c(NH4+)/c(NH3•H2O) b.c(NH3•H2O)/c(OH-)
c.c(OH-)/c(H+) d.c(H+)/c(NH4+)
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下:Fe2O3(s) + 3CH4(g)  2Fe(s) + 3CO(g) +6H2(g) ΔH>0
2Fe(s) + 3CO(g) +6H2(g) ΔH>0
① 若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为 _________ 。
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③ 该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA____KB(填“>”、“ <”或“=”)。纵坐标可以表示的物理量有哪些 。

a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将___________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,___________中的颜色较深。
试题篮
()