NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g)  2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
6-1 通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了多少倍。
6-2 动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?为什么?
如右下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+ Y(?) a Z(g)此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
a Z(g)此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )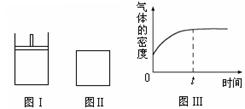
| A.物质Z的化学计量数a = 2 |
| B.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅱ>Ⅰ |
| D.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
 CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①该时间段内反应速率v(H2)= mol-1·L-1·min-1。
②比较此时正、逆反应速率的大小: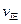
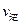 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是 。
试题篮
()