物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空:
27.上图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化 ;该变化体现出硫元素的非金属性比氧元素 (填“强”或“弱”)。用原子结构解释原因 。
28.Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
29.SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图: 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________。室温下,0.1mol/L①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是________。(用编号表示)
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
30.治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:
2CO(g) + SO2 (g) S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
煤气化和液化是现代能源工业中重点考虑的能量综合利用方案。最常见的气化方法为用煤生成水煤气,而当前比较流行的液化方法用煤生成CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
2CO(g)+O2(g)=2CO2(g) △H2
2H2(g)+O2(g)=2H2O(g) △H3
则反应CO(g) +2H2(g)=CH3OH(g) 的△H=_______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下平衡常数大小关系是K1____K2(填“>”“<”或“=”)。
②由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为______℃,实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______。
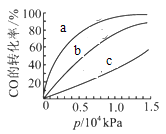
③以下有关该反应的说法正确的是_________(填序号)。
A.恒温、恒容条件下同,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2molCO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%
(3)一定温度下,向2L固定体积的密闭容器中加入1molCH3OH,发生反应:CH3OH(g) 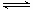 CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
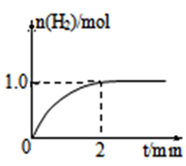
0~2min内的平均反应速率v(CH3OH)= ____________;该温度下,CO(g)+2H2(g)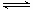 CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
A.平衡常数 B.CH3OH的平衡浓度 C.达到平衡的时间 D.平衡时气体的密度
(16分)天然气在生产、生活中具有广泛的应用。
(1)CO2(g)+4H2(g) CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
(2)另一合成CH4的原理:CO(g)+3H2(g) CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
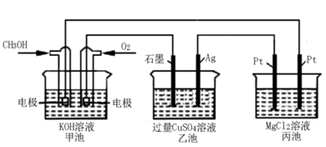
(3)某实验小组依据甲烷燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,乙池中盛有1L lmo1·L-1CuSO4溶液。a电极通入的气体为CH4,其电极反应式是______,b电极的现象为______。一段时间内乙池中溶液的pH由2变为1,则在这段时间内转移电子的物质的量为________mol。
一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是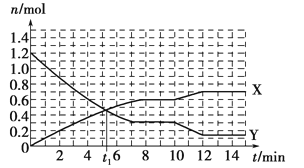
| A.t1 min时正、逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
| C.0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1 |
| D.10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1 |
(15分)乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率,某同学设计实验如表所示:
| |
0.01mol•L﹣1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol•L﹣1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s |
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是 ,表中V1= mL.
(2)可逆反应C(s)+H2O(g) H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
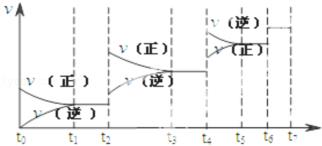
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是 、 ;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ∆H1
CO(g)+H2O(g)===CO2(g)+H2(g) ∆H2
2CO(g)+O2(g)===2CO2(g) ∆H3
则CO2(g)+CH4(g)===2CO(g)+2H2(g)的∆H= 。
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:
CO2(g)+CH4(g)  2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①该反应的平衡常数表达式为 。
②在密闭容器中通入物质的量浓度均为0.1 mol•L—1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图l所示。则压强P1 P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正) v (逆)(填“大于"、“小于”或“等于")。
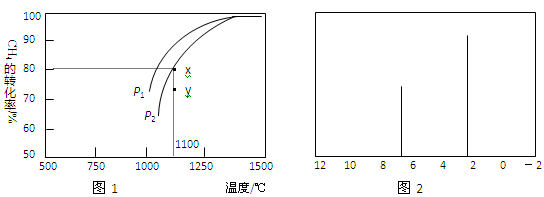
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2所示,则X的结构简式为 。
(5)科学家用氮化镓材料与铜组装如右图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
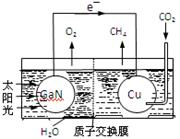
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
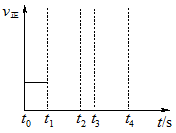
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g) CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是
CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是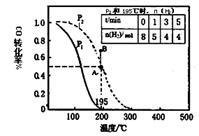
| A.0~3 min,平均速率v(CH3OH)="0.8" mol•L-1•min-1 |
| B.P1<P2,△H<0 |
| C.在P2及195℃时,该反应的平衡常数为25 |
| D.在B点时,v(正)>v(逆) |
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1
CH4可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=________。
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是___________________________。

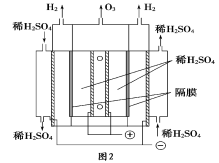
(3)臭氧也可用于烟气脱硝。
①O3氧化NO 结合水洗可产生HNO3和O2,该反应的化学方程式为______________。
②一种臭氧发生装置原理如图2所示。阳极(惰性电极)的电极反应式为___________。
(4)如图3是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为________(填化学式)和H2O。
②当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为_____________。
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示。写出Y和Z的化学式: _____________________________。
在体积均为1.0L的两个恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ) >2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)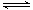 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g)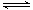 SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时,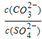 =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)  2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 
下列说法不正确的是( )
| A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1 |
| B.2c1<1.5 |
C.在该温度下甲容器中反应的平衡常数K= |
| D.2ρ1=ρ2 |
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H______0(填“>”或“<”)。
2SO3(g)的△H______0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是___________(填字母编号)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)。
试题篮
()