下列事实不能用勒夏特列原理解释的是
| A.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 |
| B.增大压强可加快SO2转化为SO3的速率 |
| C.黄绿色的氯水光照后颜色变浅 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
| A.反应混合物的浓度 | B.反应体系的压强 | C.正、逆反应的速率 | D.反应物的转化率 |
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
| A.达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20% |
| B.甲中NH3的体积分数与乙相等 |
| C.达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol N2(g)+3H2(g);△H=+Q2KJ/mol |
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=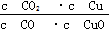 |
B.反应③的平衡常数K=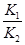 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g) 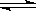 MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
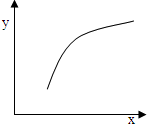
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
室温下,水的电离达到平衡:H2O H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
| A.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大. |
| B.将水加热,平衡向正反应方向移动,Kw不变 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+) |
工业制硫酸中的反应:2SO2+O2 2SO3,等量的反应物在两个容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若平衡时甲容器中SO2的百分含量p%,则平衡时乙容器中SO2的百分含量
2SO3,等量的反应物在两个容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若平衡时甲容器中SO2的百分含量p%,则平衡时乙容器中SO2的百分含量
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3mol/L | B.Y2为0.4mol/L |
| C.X2为0.2mol/L | D.Z为0.4mol/L |
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加人a mol及b mol碘化氢(a>b),待反应2HI(g)  I2(g)+H2(g)达平衡后,下列说法正确的是
I2(g)+H2(g)达平衡后,下列说法正确的是
A.从反应开始到建立平衡所需时间:tA>tB
B.平衡时I2的浓度:c(I2)A=c(I2)B
C.平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器
D.平衡时HI的分解率:αA=αB
某温度下,反应SO2(g)+ O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为
2SO2(g) + O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.4×10-4 | D.2×10-2 |
下列属于可逆反应的是
A.2SO2+O2 2SO3 2SO3 |
B.SO3+H2O=H2SO4 |
| C.HCl+NaOH=NaCl+H2O | D.2Na+2H2O=2NaOH+H2↑ |
汽车尾气净化中的一个反应如下:
 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
试题篮
()