在恒容的密闭容器中进行的可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
| A.C生成的速率和C分解的速率相等 |
| B.单位时间内生成n molA,同时生成3n molB |
| C.B的消耗速率与C的消耗速率之比为1∶1 |
| D.混合气体密度保持不变 |
下列事实不能用平衡移动原理解释的是
| A.配制FeCl3溶液时加入少量的浓盐酸 |
| B.常温下,NaOH溶液中由水电离出的c(H+)<1×10-7mol/L |
| C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| D.工业上SO2转化为SO3用五氧化二钒铁触媒作为催化剂 |
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,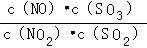 的值及SO2转化率不变 的值及SO2转化率不变 |
在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应:
A(s)+3B(g) 2C(g)+D(g) 已达平衡状态的是 ( )
2C(g)+D(g) 已达平衡状态的是 ( )
①混合气体的压强;②混合气体的密度;③B的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量
| A.①②③ | B.①③⑤ | C.①④⑤ | D.②③⑤ |
某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)  Z(g)+W(s) △H>0下列叙述正确的是( )
Z(g)+W(s) △H>0下列叙述正确的是( )
| A.加入少量W,逆反应速率增大 |
| B.升高温度,反应速率增大,平衡逆向移动 |
| C.当容器中气体压强不变时,反应达到平衡 |
| D.平衡后加入X,上述反应的△H增大 |
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),有关下列图像的说法正确的是( )
2Z(g),有关下列图像的说法正确的是( )

| A.依据图a可判断正反应为吸热反应 |
| B.在图b中,虚线可表示压强增大 |
| C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0 |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具备输氧能力。CO吸入肺中发生反应:CO + HbO2 HbCO + O2,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
HbCO + O2,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
| A.平衡常数K =c(O2)×c(HbCO)/[c(CO)×c(HbO2)] |
| B.吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比≥0.02时,人的智力才会受损 |
| D.抢救时应把CO中毒的病人放入高压氧仓中 |
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g) + m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 |
| B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 |
| D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
下列叙述中,不能用勒夏特列原理解释的是
| A.红棕色的NO2加压后颜色先变深后略变浅 |
| B.在H2O2溶液中加入MnO2后产生气泡的速率加快 |
| C.合成氨时及时将氨从反应体系中分离出去,可提高原料的利用率 |
| D.打开汽水瓶,看到大量的气泡逸出 |
下列说法中,错误的是
| A.反应的平衡转化率能表示在一定温度和一定起始浓度下反应进行的限度 |
| B.金属在发生电化学腐蚀的过程中,总是作为原电池负极的金属被氧化而腐蚀 |
| C.如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| D.SO2催化氧化时,加入过量O2时可提高SO2的转化率 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) , 某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:
| A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.若反应进行到状态D时,一定有v正>v逆 |
| D.状态A与状态B相比,状态A的c(I2)大 |
将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)  2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A.该反应的△H>0
B.NH3的体积分数不变时,该反应一定达到平衡状态
C.A点对应状态的平衡常数K(A)=10-2.294
D.30℃时,B点对应状态的υ(正))<υ(逆)
据《读卖新闻》报道,日本海洋研究开发机构正在开发一项使用镍催化剂将二氧化碳转化成甲烷的新技术。实验室模拟该过程的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g),向一个固定容积为2L的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
CH4(g)+2H2O(g),向一个固定容积为2L的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
| A.反应速率υ(H2)=0.16mol•L-1•min-1 |
| B.容器体积扩大为4L,平衡向逆反应方向移动 |
| C.向体系中再充入1molH2,CO2的转化率增大 |
| D.此条件下该可逆反应的平衡常数的数值K=25 |
试题篮
()