对可逆反应 4N3(g )+5O2 ( g)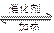 4NO(g)+ 6H2O ( g ) ,下列叙述正确的是
4NO(g)+ 6H2O ( g ) ,下列叙述正确的是
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的 n (NH3 ) : n (O 2 ) =" 4:5" |
| B.反应达到平衡后,对体系一直进行加压,平衡总是向逆向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3 ) : v正(NO)=" l" : 1 时,说明该化学反应已经达到平衡 |
在固定容积的密闭容器中,可逆反应2X + Y(g) Z(s) 已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是

| A.若X为非气态,则正反应为吸热反应 |
| B.正反应为放热反应,X为气态 |
| C.在平衡混合物中加入少量Z,则平衡向左移动 |
| D.压强变化对该平衡没有影响 |
在一定体积的密闭容器中放入3升气体R和7升气体Q,在一定条件下发生反应:3R(气)+5Q(气)="=" 4X(气)+nY(气)反应完全后,容器温度不变,混和气体的压强是原来的110%,则化学方程式中的n值是:
| A.2 | B.3 | C.4 | D.5 |
可逆反应aA(?)+2 B(g)  2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是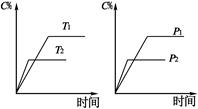
| A.达到平衡后,加入催化剂,则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
试题篮
()