可逆反应H2(g)+I2(g) 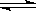 2HI(g)
2HI(g)  H<0, 达到平衡后,当改变外界条件如物质浓度、体系压强等而发生下列项目的变化时,能做为平衡一定发生了移动的标志的是( )
H<0, 达到平衡后,当改变外界条件如物质浓度、体系压强等而发生下列项目的变化时,能做为平衡一定发生了移动的标志的是( )
| A.气体的密度变小了 | B.反应物和生成物浓度均变为原来的2倍 |
| C.气体的颜色变深了 | D.体系的温度发生了变化 |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
| A.t5时增大了压强 |
| B.t3时降低了温度 |
| C.t2时加入了催化剂 |
| D.t4~t5时间内转化率一定最低 |
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
| A.以X的反应速率为0.001 mol·L-1·s-1 |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |
在恒容密闭容器中存在下列平衡:

 。
。 的平衡物质的量浓度
的平衡物质的量浓度 与温度T的关系如右图所示。下列说法错误的是( )
与温度T的关系如右图所示。下列说法错误的是( )
A.反应   的 的 |
B.在 时,若反应处于状态 时,若反应处于状态 ,则一定有 ,则一定有 |
C.平衡状态 与 与 相比,平衡状态 相比,平衡状态 的 的 小 小 |
D.若 时的平衡常数分别为 时的平衡常数分别为 ,则 ,则 |
能证明反应:H2(g)+ I2(g)  2HI(g)已经达到平衡状态的是
2HI(g)已经达到平衡状态的是
①c(H2):c(I2):c(HI)=1:1:2
②单位时间内生成nmolH2的同时消耗nmolI2
③反应速率2v(H2)=2v(I2)= v(HI)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
| A.①③ | B.②⑥ | C.③⑥ | D.④⑤ |
光气(COCl2)的分解反应为:COCl2(g) Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
下列说法正确的是
| A.COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)< v(15~16) |
| B.第10 min时,改变反应条件,反应重新达到平衡前:v(正)>v(逆) |
| C.第12 min时,反应重新达到平衡,c(COCl2)≈ 0.03 mol·L-1 |
| D.第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |
下列图示与对应的叙述相符的是
| A.图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
已知反应:2 E (l)  U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )
| A.该反应的∆H > 0 |
| B.b代表50℃下E的Y-t曲线 |
| C.m点(66,0.113)时有: ∆n (E, 20℃) = ∆n (E,50℃) |
| D.升高温度可以缩短达到平衡的时间,提高E的转化率 |
在t℃向一密闭容器中放入1mol A 和1 mol B发生反应:A(固) + B(气) C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
| A.2molA和1molB | B.2molD和1mol A 和 1molB |
| C.1molC和2molD 和1molB | D.1molC和1molD |
在一密闭容器中,mA(g)+bB(g) pC(g)反应平衡时,测得c(A)为0.5 mol·L-1,在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol·L-1,则下列判断中正确的是
pC(g)反应平衡时,测得c(A)为0.5 mol·L-1,在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol·L-1,则下列判断中正确的是
A.平衡向正反应方向移动了 B.物质B的转化率减小了
C.化学计量数:m+n<p D.物质C的质量分数增加了
在密闭容器中进行下列反应: M(g) + N(g)  R(g) + 2L(? )此反应符合该图,下列叙述正确的是
R(g) + 2L(? )此反应符合该图,下列叙述正确的是
| A.正反应吸热 ,L是气体 |
| B.正反应吸热, L是固体 |
| C.正反应放热 ,L是气体 |
| D.正反应放热 ,L是固体或液体 |
在一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)  2C(g)达到平衡的标志的是 ( )
2C(g)达到平衡的标志的是 ( )
①C的生成速率是B的生成速率的2/3倍
②单位时间生成a mol A,同时生成3a mo1B
③A、B、C的浓度不再变化
④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化
⑥单位时间消耗 a mol A,同时生成3amolB
⑦A、B、C 的分子数目比为1∶3∶2
A.②⑦ B.⑥④ C.①③ D.⑤⑥
恒温、体积为1L的密闭容器中,充入2molPCl3和1molCl2发生下述反应:
PCl3 (g)+ Cl2(g)  PCl5 (g)达到平衡时,PCl5为0.4mol。如果从体系中移走1molPCl3和0.5molCl2,重新达到平衡时,PCl5的物质的量可能为( )
PCl5 (g)达到平衡时,PCl5为0.4mol。如果从体系中移走1molPCl3和0.5molCl2,重新达到平衡时,PCl5的物质的量可能为( )
| A.0.15 mol | B.0.2 mol | C.0.24 mol | D.0.48 mol |
在溶液中,反应
 C分别在三种不同实验条件下进行,它们的起始状态均为
C分别在三种不同实验条件下进行,它们的起始状态均为 、
、 、
、 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )
。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )
| A.反应的平衡常数:①<② |
B.反应A+2B C的 C的 |
| C.实验②平衡时B的转化率为60% |
D.实验③平衡时 |
试题篮
()