如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。
其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):3X(g)+Y(g) 2 Z(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
2 Z(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
| A.平衡时气体的平均摩尔质量:M(Ⅰ) <M(Ⅱ) |
| B.平衡时气体的密度:ρ(Ⅰ)>ρ(Ⅱ) |
| C.平衡时Ⅰ和Ⅱ中Z的百分含量z%(Ⅰ) > z% (Ⅱ) |
| D.平衡时气体的压强P(Ⅰ)<P (Ⅱ) |
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
| A.如混合气体的压强不变,说明反应已达化学平衡状态 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点 |
| C.25~30 min内用NO2表示的平均化学反应速率是0.08 mol·L-1·min-1 |
| D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度 |
相同温度下,在体积相等的二个恒容密闭容器中发生可逆反应:
N2 (g)+3H2(g) 2NH3(g)△H=" —92.4" kJ/mol。
2NH3(g)△H=" —92.4" kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
6 |
0 |
放出热量bkJ |
下列叙述正确的是( )
A.放出热量关系:b>2a B.放出热量关系:b =2a
C.达平衡时氨气的体积分数:①>② D.N2的转化率:①<②
一定条件下,下列反应中反应物的转化率随反应时间的变化趋势符合下图的是: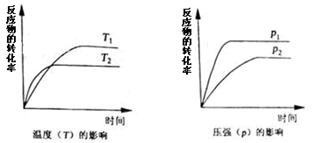
A.2NO2 N2O4 (正反应放热) N2O4 (正反应放热) |
B.NH4HCO3(s)  NH3+H2O (g)+CO2(正反应吸热) NH3+H2O (g)+CO2(正反应吸热) |
C.H2(g)+I2(g) 2HI(g) (正反应放热) 2HI(g) (正反应放热) |
D.3O2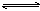 2O3(正反应为吸热反应) 2O3(正反应为吸热反应) |
某温度下,对于反应N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。
N2的平衡转化率(α~%)与体系总压强(P)的关系如下图所示。下列说法正确的是:
A.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高。
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小。
一定量的气体在密闭容器中发生反应:xA(g)+yB(g) zC(g),平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是( )
| A.平衡向正反应方向移动 |
| B.物质B的转化率降低 |
| C.x+y<z |
| D.物质C的体积分数增大 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰)>13.2 ℃<13.2 ℃Sn(s,白) ΔH3=+2.1 kJ·mol-1
下列说法正确的是( )
| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
| A.a点 | B.b点 | C.c点 | D.d点 |
有一化学平衡:mA(g)+nB(g) pC(g)+qD(g)(如图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
pC(g)+qD(g)(如图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
| A.正反应吸热:m+n>p+q |
| B.正反应吸热:m+n<p+q |
| C.正反应放热:m+n>p+q |
| D.正反应放热:m+n<p+q |
可逆反应mA(g) nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
| A.m>n,Q>0 | B.m>n+p,Q>0 |
| C.m>n,Q<0 | D.m<n+p,Q<0 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b |
| C.a<b | D.无法确定 |
在一定温度下将1 mol CO和1 mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H2O CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
| A.0.9 mol | B.0.8 mol |
| C.0.7 mol | D.0.6 mol |
如图是温度和压强对3X(?)+Y(g) 2Z(g)反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Y的体积分数。下列叙述正确的是( )
2Z(g)反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Y的体积分数。下列叙述正确的是( )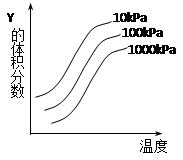
| A.升高温度正反应速率减小,逆反应速率增大,平衡向左移动 |
| B.上述反应的△H>0 |
| C.平衡体系中加入X,Y的转化率降低 |
| D.增大压强,平衡向右移动,X为气态 |
在密闭容器中发生如下反应:aX(g)+bY(g)  cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的
cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的 ,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是
,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是
| A.平衡向逆反应方向移动 | B.a+b<c+d |
| C.z的体积分数增加 | D.X的转化率下降 |
试题篮
()