(原创)下列说法不正确的是( )

甲 乙 丙 丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 |
| B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 |
C.将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 |
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。 N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。 |
某温度下,H2(g) + CO2(g) = H2O(g) + CO(g)的平衡常数K = 9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,其起始浓度如下表所示,下列判断不正确的是
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol.L-1 |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol.L-1 |
0.010 |
0.010 |
0.020 |
A.平衡时乙中CO2的转化率大于60%
B.平衡时,甲和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
在10L密闭容器中,A、B、C三种气体构成可逆反应体系,某温度下,A、B、C三者物质的量与时间的关系如图甲所示,而C的百分含量与温度的关系如图乙所示。下列说法错误的是
A.0-4min时,A的平均的反应速率为0.01mol·L-1·min-1
B.由T1向T2变化时,
C.此反应的正反应为吸热反应
D.其它条件不变时给平衡体系加压,达新平衡时,C的体积分数增大
已知:NH2COO-+2H2O  HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
| A.无法判断T1和T2的大小关系 |
| B.T1℃时,第6min反应物转化率为6.25% |
| C.T2℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1 |
| D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)⇌PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A.0.40 mol | B.0.20 mol |
| C.小于0.20 mol | D.大于0.20 mol,小于0.40 mol |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
已知某可逆反应 mA(g)+ nB(g)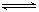 pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )

| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol/L) |
6 |
3 |
2 |
2 |
| c(B)/(mol/L) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol/L) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B⇌2C
D.在t2~t3内A的平均反应速率为:[ ]mol/(L•s)
]mol/(L•s)
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
相同温度下,相同体积的甲、乙两容器,保持体积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2。下列叙述错误的是( )
| A.化学反应速率:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.平衡时SO2的体积分数:乙>甲 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
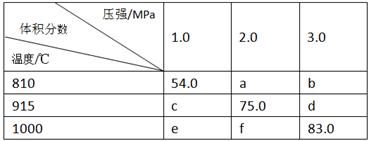
①a<54 ;②该反应的ΔS>0 ;③ 915℃、2.0MPa时E的转化率为60%;
④ 该反应ΔH<0;⑤ K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A.5个 | B.4个 | C.3个 | D.2个 |
下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.②⑤⑥ |
试题篮
()