将2.0 mol SO2气体和2.0 mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)  2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是
2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是
| A.1.6 mol SO2+0.3 mol O2+0.4 mol SO3 |
| B.4.0 mol SO2+1.0 mol O2 |
| C.2.0 mol SO2+1.0 mol O2+2.0 mol SO3 |
| D.3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
| A.若正反应是吸热反应,则A为气态 |
| B.若正反应是放热反应,则A为气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强一定对该平衡的移动无影响 |
把3.0 mol M和2.5 mol N混合于2.0 L的恒容密闭容器中,发生反应3M(g)+N(g)  xP(g)+2Q(g),5 min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15 mol·L-1·min-1,则下列说法正确的是
xP(g)+2Q(g),5 min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15 mol·L-1·min-1,则下列说法正确的是
| A.方程式中x=2 |
| B.达平衡后,容器内压强是反应起始时的2倍 |
| C.向容器中再充入3.0 mol M和2.5 mol N,达新平衡时Q的体积分数减小 |
| D.容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志 |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)  2CO(g) ΔH=Q kJ·mol-1。右图为CO2、CO的物质的量n随时间t的变化关系图:
2CO(g) ΔH=Q kJ·mol-1。右图为CO2、CO的物质的量n随时间t的变化关系图:
下列说法正确的是( )
| A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min时,v(CO)=v(CO2) |
B.当容器内的压强不变时,反应一定达到平衡状态,且 <1 <1 |
C.3 min时温度由T1升高到T2,则Q>0,再达平衡时 =4.7 =4.7 |
| D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化, |
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示。下列判断不正确的是:
| A.t1时刻,v(正)>v(逆) | B.t2时刻, v(正)=v(逆) |
| C.t2时刻,反应达到最大限度 | D.t3时刻,反应停止 |
已知某可逆反应 mA(g)+ nB(g)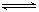 pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )

| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol/L) |
6 |
3 |
2 |
2 |
| c(B)/(mol/L) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol/L) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B⇌2C
D.在t2~t3内A的平均反应速率为:[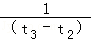 ]mol/(L•s)
]mol/(L•s)
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
相同温度下,相同体积的甲、乙两容器,保持体积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2。下列叙述错误的是( )
| A.化学反应速率:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.平衡时SO2的体积分数:乙>甲 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
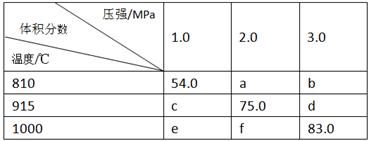
①a<54 ;②该反应的ΔS>0 ;③ 915℃、2.0MPa时E的转化率为60%;
④ 该反应ΔH<0;⑤ K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A.5个 | B.4个 | C.3个 | D.2个 |
下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.②⑤⑥ |
试题篮
()