在一定温度下将100mLN2,H2混合气充入密闭恒压容器内,发生反应达到平衡时维持温度不变,测得混合气的密度是反应前密度的1.25倍,平均分子量为15.5。求平衡时N2的转化率;N2,H2两种气体开始时各为多少毫升?
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/s 浓度mol·L-1 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4)mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)达到平衡时N2O4的转化率为 %,表中c2 c3,a b (选填“>”“<”“=”)。
(2)20s的四氧化二氮的浓度c1= mol·L-1,在0s~20s内四氧化二氮的平均反应速率为 mol·(L·s)-1;。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
在127℃和1.0×105Pa时,向某容器中放入18.4gN2O4使之发生反应N2O4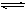 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)已知:1/2O2(g)=1/2O2+(g)+1/2e- △H1=587.9kJ/mol K1
PtF6(g)+e-=PtF6-(g) △H2=-771.1kJ/mol K2
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482.2kJ/mol K3
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________,K=_______(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。

①T℃、p Pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是_____。
A.混合气体的平均相对分子质量不再变化
B.容器内压强不再变化
C.v正(CO2)=v逆(FeO)
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为_____,平衡时混合气体的密度与起始时气体的密度之比为_______。
(3)在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及特定平衡状态见下表。
2NH3,有关数据及特定平衡状态见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2molN2 |
3molH2 |
0molNH3 |
1.5molNH3 |
同种物质的体积分数相同 |
| 乙 |
amolN2 |
bmolH2 |
0molNH3 |
1.2molNH3 |
起始时乙容器中的压强是甲容器的____倍。
在10L密闭容器中,放入8.0gSO3在一定条件下反应:2SO3(g)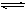 2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
某温度下,将4mol N2与8 mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
⑴计算该温度下的平衡常数K;
⑵计算该条件下N2的转化率;
⑶如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率__________;H2的转化率__________(上述两空选填“增大”、“减小”或“不变”)。
在一定条件下将物质的量相等的NO和O2混合发生如下反应:2NO+O2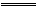 2NO2,2NO2
2NO2,2NO2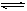 N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均相对分子质量。
N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均相对分子质量。
一定温度下,在密闭容器中,发生反应: 2NO2 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度? ;
(2)此时NO2的转化率? 。
某温度下在密闭容器中发生如下反应:
2M(g)+N(g) 2E(g)
2E(g)
开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为多少?
将一定量的SO和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2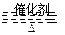 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
在一密闭容器中发生反应: 2A(g)+B(g) E(g)
E(g)
(1)写出该反应的平衡常数表达式___________ ____,已知升高温度时,v(正)>v(逆),此时K值__ __(填“变大”“变小”或“不变”);该反应的△H_____0(填“>”、“=”、“<”);
(2)将1.0mol A和1.0mol B混合后装入2L容器中发生反应,E的物质的量的变化如图所示。
①3分钟内E的平均反应速率为________ _________;
②求此温度下该反应的平衡常数K= (结果保留小数后1位);
③请在图中画出5分钟内A的物质的量变化的曲线;
(3)已知在如图所示的变化中,平衡常数K保持不变,则在5~7min内引起E的物质的量变化的原因可能是____________(填编号)。
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积 ⑤缩小了容器的体积 ⑥减少了A的物质的量。
2向一个容积为2L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应: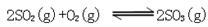 ,经4 s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)以O2表示的该反应的速率;(2)平衡时SO3的物质的量浓度。
,经4 s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)以O2表示的该反应的速率;(2)平衡时SO3的物质的量浓度。
把2.5molA和2.5molB混合盛入容积为2L的密闭容器里,发生如下反应:
3A(g) +B(g) x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应
x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应
速率为0.2mol·L-1·s-1 , 同时生成1molD,试计算:
(1)达到平衡状态时B的转化率?
(2)计算x的值?
(3)达到平衡状态时容器内气体的物质的量是多少?
试题篮
()