以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
②由图可知,随着温度升高: 。
在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)平衡常数K。
一定条件下,可逆反应:A2+B2 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
请回答:
(1)a、b应满足的关系是 (2)a的取值范围是
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到平衡,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(mol/L) 浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。
在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡,此时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)平衡常数K。
在一定温度下,向10 L密闭容器中充入5.2 mol NO2,达到平衡时, c(N2O4)="0.16" mol·L-1。
请计算该温度下此反应的平衡常数K(请用三段式的方法写出计算过程)。
在体积固定的密闭容器中N2与H2发生反应:N2(g)+3 H2 2 NH3
2 NH3
达到平衡时c (N2)=3.5 mol·L-1,c (H2)=1 mol·L-1,c (NH3)=5 mol·L-1,求:
(1)N2和H2的起始浓度
(2)N2的转化率(要求有解题过程)
已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g) CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
(1)求4 min内H2的平均化学反应速率。
(2)计算800℃时该反应的平衡常数。
(3)427℃时该反应的化学平衡常数为9.4,请结合(2)中的计算结果判断该反应的ΔH 0(填“>”、“<”或“=” )。
恒温时,在某密闭容器中通入2molA(g)和1molB(g),发生如下反应:
2A(g)+B(g) 2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
(1)与上述平衡保持同温、同压,另取4molA(g)和2molB(g)达平衡,则C的体积分数为多少?平衡时,气体的总物质的量是多少?
(2)在另一密闭容器中,通入n(A) molA(g)和n(B)molB(g),若保持平衡时C的体积分数仍为0.4,则恒有an(B)<n(A)<bn(B),问a、b各为多少?
在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H2 2NH3,反应进行到2min时,测得容器内有2molN2,求:
2NH3,反应进行到2min时,测得容器内有2molN2,求:
(1)2min时的N2的浓度?(2)2min内的平均速率υ(NH3)?
(3)反应前后容器中气体压强之比?(4)NH3的分解率?
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) ="====" 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
PCl5的热分解反应如下:PCl5(g)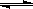 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。
.已知一氧化碳与水蒸气的反应为CO+H2O CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。
CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)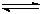 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡, v(H2)=________;该温度下CO(g)+2H2(g) 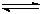 CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
试题篮
()