恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
已知I、II反应在一定条件节焓变及平衡常数如下:
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g) S2(g)+4H2O(g)的△H
S2(g)+4H2O(g)的△H
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2, 10min时反应达到平衡。测得10min V(H2S)=0.08 mol·L-1·min-l,则该条件下的平衡常数为 L·mo1-l,若此时再向容器中充H2、S2、H2S各0.8mol,则平衡移动方向为 (填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化率为25%,据此判断△H1 0(填“>”或“<”),与T1时相比,平衡常数K1 (填“增大”、“减小”或“不变”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是 (写出主要反应的离子方程式),该溶液中,[Na+] 2[ SO ]+ [HSO
]+ [HSO ](填“>”、“<”或“=”)。
](填“>”、“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO 的水解平衡常数= mol·L-1.
的水解平衡常数= mol·L-1.
研究证明,CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
反应开始时在0.lMPa下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的物质的量百分数如图1所示:
请回答下列问题:
(1)△H4= kJ-mol-1。
(2)可以判断该反应已经达到平衡的是 。
A.v(CO2)="2" v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为 (写化学式),判断依据是 。
(4)为提高CO2的平衡转化率,可以采取的措施是 。
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值。
运用化学反应原理分析解答以下问题。
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
| 弱酸 |
电离平衡常数(25℃) |
| HClO |
K=2.98×10-8 |
| H2CO3 |
K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 |
K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,升高温度,K值______(填“变大”、“变小”或“不变”)。
②下列离子方程式和有关说法错误的是 。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+ H2O + CO2 =" 2HClO" + CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-= 2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)< c(NaClO)< c(Na2SO3)
d.相同温度时,等物质的量浓度三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3) >V(H2SO3) >V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: ,该反应的氧化产物是 。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是 。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是 。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH‾(aq)
Cr3+(aq)+3OH‾(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的化学平衡常数K= L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K= L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
甲醇是一种重要的化工原料,在生产中有着重要应用。工业上用甲烷氧化法合成甲醇,反应流程中涉及如下反应(下列焓变数据均在25℃测得):
(1)25℃时,用CH4和O2直接制备甲醇蒸气的热化学方程式为________________;
(2)某温度下,向容积为4 L的恒容密闭容器中通入6 molCO2和6 mol CH4,发生反应①,5 min后反应在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5 min内的平均反应速率v(CO)=________mol·L-1·min-1;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数________(填“增大”“不变”或“减小”);
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,25℃时,其反应的热化学方程式为:
科研人员对该反应进行了研究,部分研究结果如下图所示:
①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸甲酯应选择的是_______(填下列序号字母)
a.3.5×106Pa b.4.0×l06Pa c.5.0×106Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是______________
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
①通入气体a的电极是电池的_____(填“正”或“负”)极,其电极反应式为__________;
②25℃时,用此电池以石墨作电极电解0.5 L饱和食盐水(足量),若两极生成的气体共1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为_____(忽略溶液体积的变化)。
氧和硫的化合物在化工生产上应用非常广泛。试回答下列问题:
(1)O3可通过电解稀硫酸(原理如下图所示,该条件下3O2=2O3可以发生)制得。图中阳极为 (填A或B)。若C处通入O2,则A极的电极反应式为: ,若C处不通入O2 ,D、E处分别收集到1mol和0.4mol气体, 则E处收集的气体中O3所占的体积分数为 (忽略O3 的分解)。
(2)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。己知:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235" kJ/mol;
2 Ag2O(s)===4Ag(s)+O2(g);△H = +60kJ/mol;
则反应 2O3(g)= 3O2(g)的△H = 。
(3)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g)△H=+98 kJ·mol-1。某温度时向体积为2 L的恒容密闭容器中充入0.20mol SO2Cl2,达到平衡时,容器中含0.1mol SO2,该温度时反应的平衡常数为____(请带单位)。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g)△H=+98 kJ·mol-1。某温度时向体积为2 L的恒容密闭容器中充入0.20mol SO2Cl2,达到平衡时,容器中含0.1mol SO2,该温度时反应的平衡常数为____(请带单位)。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(4)对(3)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图所示。
①0~20min反应的平均速率υ(SO2Cl2)=___________。
②下列叙述正确的是
A.A点υ正(SO2Cl2)>υ逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强 ,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(用化学方程式表示为可逆反应)________;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因________。
(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的和,反应原理为: 2CO(g)+2NO (g) 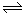 CO2(g)+N2 (g) △H<0,某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
CO2(g)+N2 (g) △H<0,某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示: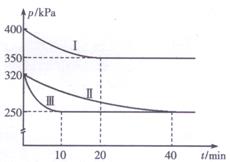
①计算实验Ⅱ从开始至达到平衡时的反应速率v(N0)=________。
②图中三组实验从开始至达到平衡时的反应速率v( NO)由大到小的顺序为__________(填实验序号)。
③与实验Ⅱ相比,实验I和实验Ⅲ分别仅改变一种反应条件,所改变的条件和判断的理由为:
实验I__________________________________________;
实验Ⅲ________________________________________。
④三组实验中CO的平衡转化率α1(CO)、αII(CO)和αIII(CO)的大小关系为____________。
⑤计算实验Ⅲ的平衡常数K=____________。
(1) 氨催化氧化法是工业制硝酸的主要方法,可进行连续生产。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式_____________________________。
(2) 恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①写出合成氨反应N2(g)+3H2(g) 2NH3(g)的平衡常数表达式:__________________________
2NH3(g)的平衡常数表达式:__________________________
②上表中K1_______K2(填“>”、“=”或“<”)。
(3) 如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图。
①下列说法正确的是__________(填序号)。
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2) =3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为 。
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式 。
(5)25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( )。
A.25 ℃时,饱和Mg(OH)2溶液中c(OH—)大于饱和MgF2溶液中c(F—)
B.25 ℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.056 1 mol·L-1,则溶液的pH=9
C.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)CO2的电子式为: 。
(2)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(3)甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的燃料电池装置。
①该电池负极的电极反应为: 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
(5)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。利用图中a点对应的数据,计算出曲线Z在对应温度下 CO(g)+ 2H2(g) CH3OH(g)的平衡常数K = 。
CH3OH(g)的平衡常数K = 。
(6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
I.短周期元素X、Y、Z在元素周期表中的位置如下图所示,其中Y元素原子的最外层电子数是电子层数的两倍。回答下列问题:
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: 。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐。该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) 。
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键。该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体。该反应的化学方程式为 。
II.已知可逆反应:CO(g)+H2O(g)  CO2(g)+H2(g),平衡常数见下表:
CO2(g)+H2(g),平衡常数见下表:
| 温度/℃ |
500 |
700 |
850 |
1 000 |
| 平衡常数 |
2.5 |
1.7 |
1.0 |
0.6 |
(5)该反应ΔH 0(填“<”或“>”)。
(6)850 ℃时,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件是 。
若x=5.0,当反应达到平衡时,n(H2)= 。
X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
(1)Y的原子结构示意图是_______________.
(2)甲的水溶液与硫酸铝溶液反应离子方程式 .
(3)甲与氯化氢反应生成乙.乙所含化学键类型有 .在0.1mol•L﹣1乙溶液中,所含离子浓度由大到小的顺序是 .
(4)工业上,可通过如下转化制得尿素晶体:
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH3产率的是 。
②反应Ⅱ:2NH3(g)+ CO2(g)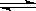 CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(i)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(ii)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
已知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1
写出CO(NH2)2(g)与NO反应的热化学方程式 。
以天然气为原料合成氨是当下主流合成氨方式,其过程简示如下: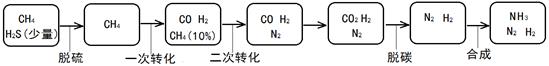
(1)甲烷脱硫的主要目的是 。
(2)甲烷一次转化发生反应:CH4(g)+H2O(g) 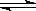 CO(g)+3H2(g)
CO(g)+3H2(g) 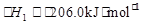 。
。
在20L的密闭容器中充入CH4(g)、H2O(g)各1mol,CH4的平衡转化率与温度、压强的关系如图。压强P1 (选填>、<、=)P2;若3min后在150℃、压强为P2时达到平衡,平均反应速率v(H2)= 。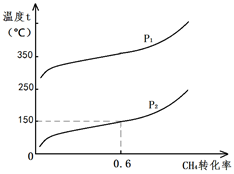
(3)传统的化学脱碳法是用热碳酸钾溶液洗气,用什么方法可以使洗气后的碳酸钾溶液再生以循环使用? 。
铜洗能较彻底脱碳脱硫。醋酸亚铜溶于过量氨水形成的铜洗液,可吸收H2S、O2、CO、CO2等,该铜洗液吸收CO2的化学方程式: 。
(4)n(N2) :n(H2)="1" : 3原料气进入合成塔,控制反应条件之外采取什么措施提高原料气利用率? 。
(5)NaCl、NaBr、NaI混合溶液中滴入AgNO3溶液至c(Ag+)="0.07" mol·L-1,溶液中浓度比
c(Cl-):c(Br-):c(I-) = : :1。
| |
AgCl |
AgBr |
AgI |
| Ksp |
2×10-10 |
5×10-13 |
1×10-16 |
(14分)一定温度下,向2L的密闭容器中充入2molPCl3(g)和1molCl2(g),发生反应:PCl3(g)+Cl2(g) PCl5(g),5min达平衡,容器中的压强为开始时的
PCl5(g),5min达平衡,容器中的压强为开始时的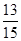 ,并且放出37.2kJ的热量,请回答下列问题:
,并且放出37.2kJ的热量,请回答下列问题:
(1)前5min内,v(Cl2)= mol·L-1·min,此温度下,平衡常数K= 。
(2)下列哪个图像能正确说明上述反应在进行到t1时刻时,达到平衡状态 。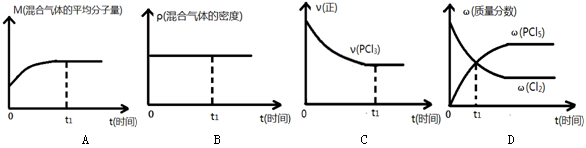
(3)平衡后,从容器中移走0.4molPCl3,0.2molCl2和0.2molPCl5,则平衡 (填“正向移动”“逆向移动”或“不移动”),c(PCl3) (填“增大”“减小”或“不变”)。
(4)相同条件下,若起始时,向2L的密闭容器中充入1molPCl3(g)和1molPCl5(g),反应达平衡后,理论上吸收 kJ的热量。
(5)PCl5与足量的水能完全反应生成H3PO4和HCl,将反应后的混合液逐滴加入到过量的Na2CO3溶液中,请写出可能发生反应的离子方程式 (已知:H3PO4的电离平衡常数:Ka1=7.52×10-3,Ka2=6.23×10-8,Ka3=2.2×10-13;H2CO3的电离平衡常数:Ka1=4.3×10-7,Ka2=5.61×10-11)
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)25℃时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: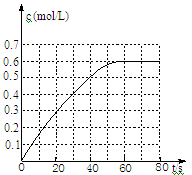
①25℃时,该反应的平衡常数为 ;
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在120℃进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时v(正) v(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点。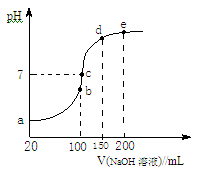
①b点时,溶液中发生水解反应的离子是 ;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
试题篮
()