下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| C.在合成氨的反应中,降温或加压有利于氨的合成 |
| D.H2、I2、HI平衡混合气加压后颜色变深 |
研究发现,含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(1)雾霾中能形成酸雨的物质是_____________。
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
N2(g)+O2(g) 2NO(g) △H =" +180.50" kJ·mol-1
2NO(g) △H =" +180.50" kJ·mol-1
①下列表示NH3(g)与NO(g)在一定条件下反应,生成无污染气体的能量转化关系示意图正确的是:___________(填字母)

② 右图是反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。
5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。

(3)右图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,

① 阴极的电极反应式是 。
② 物质A是_____________(填化学式),理由是_________________________。
(4)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,请解释:

① 随空/燃比增大,CO和CxHy的含量减少的原因是 。
② 当空/燃比达到15后,NOx减少的原因可能是_____________。
活性炭可处理大气污染物NO,反应原理:C(s) + 2NO(g) N2(g) + CO2(g)。T℃时,在2L密闭容器中加入0.100 mol NO和2.030 mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是
N2(g) + CO2(g)。T℃时,在2L密闭容器中加入0.100 mol NO和2.030 mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是
| A.该温度下的平衡常数是:K=9/16 |
| B.达到平衡时,NO的转化率是60% |
| C.3min末达到平衡,则v( NO ) = 0.01mol/(L·min) |
| D.升高温度有利于活性炭处理更多的污染物NO |
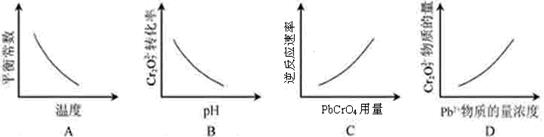
仅根据题中图示得出的结论不合理的是
| |
A |
B |
C |
D |
| 图示 |
 |
 |
 |
 |
| 结论 |
HB为弱酸 |
HF为弱电解质 |
溶解度:AgI<AgCl |
正反应 △H>0 |
工业上以乙苯催化脱氢制取苯乙烯的反应如下: (g)
(g)
 (g) + H2(g)
(g) + H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定。在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示。已知:气体分压(p分)=气体总压(p总)× 体积分数。
不考虑副反应,下列说法正确的是
| A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低 |
| B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动 |
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= × p总 × p总 |
| D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍 |
在密闭容器里,通入x mol H2(g)和y mol N2(g),发生反应3H2(g)+N 2(g)  2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
(1)升高温度 , ;(2)加入催化剂 , ;
(3)充入更多的H2 , ;(4)扩大容器的体积 , ;
(5)容器容积不变,通入氖气 , 。
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是( )
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是( )
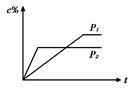
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
反应CO+H2O(g) CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是( )
CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是( )
| A.将压强减小至原来的一半 | B.添加催化剂 |
| C.将反应温度升高至1200 K | D.增大水蒸气的浓度 |
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)  TaI4(g)+S2(g) ΔH>0 (Ⅰ)
TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2的晶体,则温度T1______T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为______________,滴定反应的离子方程式为___________________。
(4)25 ℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
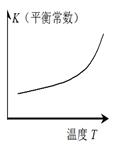
Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应2SO2(g)+O2(g) 2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
工业上制取氢气除电解水外还有多种方法.
(1)工业上可用组成为K2O•M2O3•2RO2•nH2O的无机材料纯化制取氢气.
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R在周期表的位置为 .
②常温下,不能与M单质发生反应的是 (填序号).
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)工业上也可利用化石燃料开采、加工过程中产生的H2S废气制取氢气.
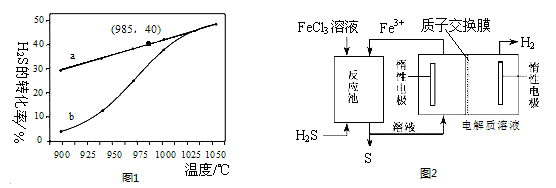
①高温热分解法 已知:H2S(g)⇌H2(g)+S(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果见图1.图中a为H2S的平衡转化率与温度关系曲线,b为表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率的变化曲线.据图计算985℃时H2S按上述反应分解的平衡常数K= ;随着温度的升高,曲线b向曲线a逼近的原因是
②电化学法:该法制取氢气的过程如图2所示.反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 .
反应后的溶液进入电解池,电解总反应的离子方程为 .
(3)H2S在足量氧气中燃烧可以得SO2,若在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol.若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,SO3的物质的量的取值范围为 mol.
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
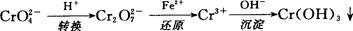
已知转化过程中的反应为
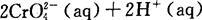
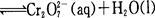 [MCr=52,M(FeS04·7H2O)=278]
[MCr=52,M(FeS04·7H2O)=278]
转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeS04·7H2O)作还原剂,处理1 L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.2V正(CrO42-)= V逆(Cr2O72-)时,反应处于平衡态 |
试题篮
()