运用有关概念判断下列叙述正确的是()
| A. |
1
|
| B. |
|
| C. |
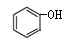 和 和
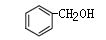 互为同系物 互为同系物
|
| D. |
|
在标准状况下,将一定量的氨气溶于水,得到密度为 a g·cm-3 的氨水 b g,物质的量浓度为 c mol·L-1,则溶于水中的氨气的体积是
A. |
B. |
C. |
D. |
电解饱和食盐水,当阴极附近有0.8molNaOH生成时,导线中通过电子的物质的量是( )
| A.0.16mol | B.0.8 mol | C.0.4mol | D.0.2mol |
相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是( )
| A.Na2CO3NH4Cl CH3COOH H2SO4 |
| B.Na2CO3H2SO4 CH3COOH NH4Cl |
| C.NH4Cl H2SO4 CH3COOH Na2CO3 |
| D.NH4Cl CH3COOH H2SO4 Na2CO3 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
| A.原混合酸中NO3-物质的量为0.4 mol |
| B.原混合酸中H2SO4浓度为2.0 mol·L-1 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
阴离子 含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
A. mol mol |
B. mol mol |
C. mol mol |
D. mol mol |
将1mol SO2和1mol O2通入一个固定容积的密闭容器中,在一定温度下反应达到平衡,平衡体系中有SO3 0.3mol,此时若移走0.5mol O2和0.5 mol SO2,则反应达到新平衡时SO3的物质的量为( )
| A.0.3mol | B. 0.15mol |
| C.小于0.15mol | D.大于0.15mol,小于0.3mol |
标准状况下将VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是( )
| A.w = 17c/(1000ρ) | B.ρ=" (17V+22400)" /(22.4+22.4V) |
| C.w = 17V/(17V+22400) | D.c = 1000Vρ/(17V+22400) |
用等体积的0.1 mol/L的BaCl2溶液,可使相同体积的Fe2 (SO4 )3、 Na2SO4、 KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
| A.3∶2∶3 | B.3∶1∶2 | C.2∶6∶3 | D.1∶1∶1 |
下列说法不正确的是( )
| A.等物质的量的—CH3与—OH所含电子数相等 |
| B.7.80gNa2O2与5.85gNaC1所含阴离子数相等 |
| C.等质量的C2H4和C3H6中所含C—H键数相等 |
| D.等体积、等密度下的12C18O和14N2所含质子数相等 |
将质量分数为a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发,且蒸发过程中无溶质析出),所得溶液体积为V L,溶质的质量分数为蒸发前的2倍.设溶质的式量为M,则蒸发后所得溶液的物质的量浓度为( )
A. |
B. |
C. |
D. |
下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A.将58.5gNaCl溶解在1L水中 |
| B.将1L10mol/L的浓盐酸加入9L水中 |
| C.将22.4LHCl气体溶于水配成1L溶液 |
| D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
试题篮
()