在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 , (答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实 验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1H2SO4 / mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:其中:V2 V5(填“>”、“<”或“=”);
V5= , V6= ,V8= ;(填具体数值)
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/S |
X/mol |
Y/mol |
Z/mol |
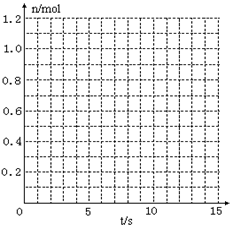 |
| 0 |
1.00 |
1.00 |
0.00 |
|
| 1 |
0.90 |
0.80 |
0.20 |
|
| 3 |
0.75 |
0.50 |
0.50 |
|
| 5 |
0.65 |
0.30 |
0.70 |
|
| 9 |
0.55 |
0.10 |
0.90 |
|
| 10 |
0.55 |
0.10 |
0.90 |
|
| 14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是______________;
(3)列式计算该反应在0-3S时间内产物Z的平均反应速率:_______________;
(4)该反应达到平衡时反应物X的转化率等于___________________________;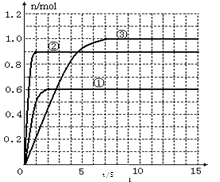
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:①_________②________③________。
(I)向一体积不变的密闭容器中充入2 mol A,0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) 3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
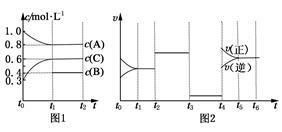
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=__________。
(2)t3时改变的条件为__________________,B的起始物质的量为__________________,
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,
写出此条件下该反应的热化学方程式:__________________。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol。
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
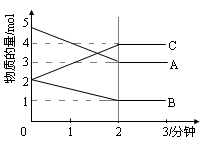
(1)该反应的化学方程式: ;
(2)反应开始至2min末,A的反应速率为 ;
(3)该反应是由 开始进行的。填序号
①正反应 ②逆反应 ③正逆反应同时
氮可形成多种氧化物,如NO、NO2、N2O4等。
(1)电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____,理由是:_____________________________。

(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2‾)和c(CH3COO‾)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400 mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g) N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0. 08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol/(L.min);n3 n4(填“>”、“<”或“=”),该反应的平衡常数的值为 。
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是 mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为 。
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
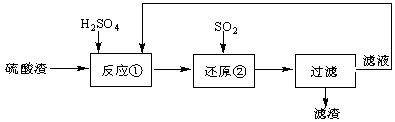
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
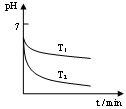
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____ _____.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g) △H=___________;则该反应( )
| A.任何温度下都能进行 |
| B.任何温度下都不能进行 |
| C.高温下能自发进行 |
| D.低温下能自发进行 |
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol•L﹣1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正__________ v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=__________.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示。请认真观察下图,然后回答问题。

(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量,该反应的△H= (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) =H2O(g) △H= -241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能 ,单位体积内活化分子的百分数 ,因此反应速率 ,(前面的三个空填“增大”“减小”“不变”)你认为最可能的原因是 。
在一密闭容器中发生反应N2+3H2 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:

(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=________已知K300℃<K350℃,则ΔH_______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为___________,D的平均反应速率为___________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
向2L密闭容器中加入0.15 mol·L-1A、0.05 mol·L-1C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
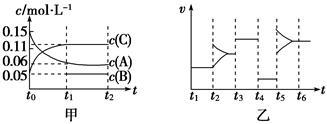
(1)若t4时改变的条件为减小压强,则B的起始物质的量为____________mol。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:_______________________。
(3)t3时改变的某一反应条件可能是________(选填序号)。
A.t3时刻,增大了X的浓度 B.t3时刻,升高了体系温度
C.t3时刻,缩小了容器体积 D.t3时刻,使用了催化剂
(4)在恒温恒压下通入惰性气体,v(正)_________v(逆)(填“>”、“=”或“<”)。
(5)如图两个容器A、B中,A容器的容积保持不变,B容器保持和外界大气压一致。开始时,在保持两个容器体积相等的情况下,分别同时充入2moLH2S和1moLSO2。反应开始后两容器内反应平均反应速率A B (填“大于”、“小于”或“等于”)。
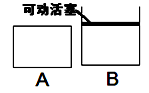
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g) N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA__________vB(填“>”、“<”或“=”);若打开活塞K2,气球B将__________(填“变大”、“变小”或“不变”)。
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将____________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将____________,B中NO2的转化率将__________(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,__________中的颜色较深。
某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为____________mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v= 。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
在一密闭容器中充入1 mol H2和1 mol I2(g),压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)="==2HI(g)" ΔH<0。
(1)保持容器容积不变,向其中加入1 mol H2,反应速率________(填加快、不变或者减慢,下同),理由是_________________________。
(2)保持容器容积不变,向其中加入1 molHe,反应速率________,理由是__________________。
(3)保持容器内气体压强不变,向其中加入1 mol He,反应速率________,理由是__________。
(4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率________,理由是________________________________。
(5)提高起始的反应温度,反应速率________,理由是________________________。
试题篮
()