将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
在一个2L的容器内充入6.0mol某气态反应物,经过3s后,它的浓度变成1.2mol/L,在3s内用该反应物浓度的变化表示的反应速率为
| A.0.6mol·L—1·s—1 | B.0.8mol·L—1·s—1 |
| C.0.4mol·L—1·s—1 | D.2.4mol·L—1·s—1 |
温度为T时;向2.0 L恒容密闭容器中充入1.0 mol PCl5;反应PCl5(g)  PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/mol |
0 |
0.16 |
0. 19 |
0.20 |
0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)="0.0032" mol·L-1·s-1
B.保持其他条件不变;升高温度;平衡时c(PCl3)="0.11" mol·L-1;则反应的ΔH<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)  SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示。由图可得出的正确结论是( )

| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| 实验[ |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O[ |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
5 |
0.2 |
10 |
| D |
35 |
5 |
0.2 |
10 |
0.1 |
5 |
对于可逆反应H2(g)+I2(g) 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是 ( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是 ( )
| A.H2(g)的消耗速率与HI(g)的生成速率之比为2∶1 |
| B.达到平衡时,各组分的浓度相等 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率相等 |
下列关于化学反应速率的说法正确的是( )
| A.化学反应速率是指一定时间任何一种反应物的减小或任何一种生成物的增加 |
| B.化学反应速率0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L |
| C.对于任何化学反应来说,反应速率越大,反应现象就越明显 |
| D.根据化学反应速率的大小可以知道化学反应进行的快慢 |
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓 度/mol·L-1 |
2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①可以判断该分解反应已经达到平衡的是_______________ 。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________________ (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_______________0(填“>”、“=”或“<”),熵变ΔS________________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O
NH4HCO3+NH3·H2O
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如下图所示。
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:______________ _______________________________。
某温度下,在体积为2 L的密闭容器中充入1 mol A和b mol B气体,发生如下反应:A(g)+B(g) 2C(g),5 min后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
2C(g),5 min后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )

A.0~5 min,C物质的平均反应速率为0.04 mol·L-1·min-1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4 mol·L-1,c(Y2)=0.6 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的化学方程式可表示为( )
A.2X2+3Y2 2X2Y3 2X2Y3 |
B.3X2+2Y2 2X3Y2 2X3Y2 |
C.X2+2Y2 XY2 XY2 |
D.2X2+Y2 2X2Y 2X2Y |
氮可形成多种氧化物,如NO、NO2、N2O4等。
(1)电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____,理由是:_____________________________。

(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2‾)和c(CH3COO‾)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400 mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g) N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0. 08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol/(L.min);n3 n4(填“>”、“<”或“=”),该反应的平衡常数的值为 。
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是 mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为 。
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
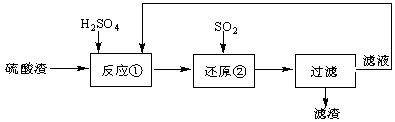
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
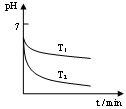
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
反应2SO2+O2 2SO3在密闭容器中进行。下列关于该反应的说法错误的是
2SO3在密闭容器中进行。下列关于该反应的说法错误的是
| A.升高温度能加快反应速率 | B.使用恰当的催化剂能加快反应速率 |
| C.增大O2的浓度能加快反应速率 | D.SO2与O2能100%转化为SO3 |
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____ _____.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g) △H=___________;则该反应( )
| A.任何温度下都能进行 |
| B.任何温度下都不能进行 |
| C.高温下能自发进行 |
| D.低温下能自发进行 |
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol•L﹣1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正__________ v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=__________.
试题篮
()