医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下: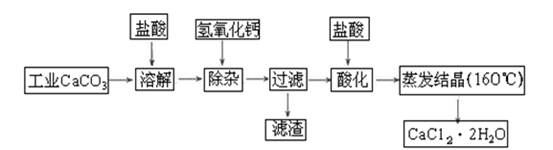 (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
________________________________________________________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________________;
(3)测定样品中Cl-含量的方法是:
a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中需用溶液润洗的仪器有__________________ ______________,
______________,
②计算上述样品中CaCl2·2H2O的质量分数为________________;
(4)已知t℃时,纯水中c(H+)=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积[Ksp[Mg(OH)2]=3.2×10- 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
(11分)(2011·滨州模拟)Ⅰ.回答下列有关常数的问题:
(1)Kw的数学表达式是________,温度升高Kw________(选填“变大”“变小”或“不变”),若定义pOH=-lgc(OH-),则pH+pOH=________(用含Kw的代数式表示)。
(2)Ka通常表示弱酸的电离平衡常数,Ka值越大表示该弱酸的酸性________。α通常称为电离度,顾名思义是表示弱电解质的电离程度大小的一个指标,对于某一元弱酸,当用蒸馏水稀释该酸时,Ka________(选填“变大”“变小”或“不变”)。α________(选填“变大”“变小”或“不变”)。
(3)Ksp表示难溶物的溶度积常数,该常数越大表示________。
Ⅱ.已知常温下,AgBr的Ksp=4.9×10-13mol2·L-2、AgI的Ksp=8.3×10-17mol2·L-2。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”“变小”或“不变”,下同);
②若改加更多的AgI,则c(Ag+)________;
③若改加AgBr固体,则c(I-)______;而c(Ag+)______。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是________。
| A.两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变 |
| C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 |
E.难溶盐电解质的Ksp与温度有关
F.同离子效应(加入与原电解质具有相同离子的物质),使难溶盐电解质的溶解度变小,也使Ksp变小
(3)现向含有NaBr、KI均为0.002 mol·L-1的溶液中加入等体积的浓度为4×10-3 mol/L AgNO3溶液,则产生的沉淀是________(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应方程式表示为:______________________________。
试题篮
()