下列图示与对应的叙述相符的是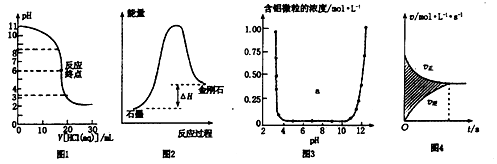
| A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线 |
| B.图2所示,石墨的熔点比金刚石低 |
| C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3 |
| D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕 |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和Cr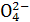 ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、Cr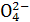 |
B.Cr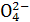 、Br-、Cl- 、Br-、Cl- |
C.Br-、Cl-、Cr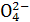 |
D.Br-、Cr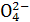 、Cl- 、Cl- |
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )。
| A.具有吸附性 | B.溶解度与CuS、PbS、CdS等相同 |
| C.溶解度大于CuS、PbS、CdS | D.溶解度小于CuS、PbS、CdS |
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是( )
| A.过滤后的溶液中一定没有S2﹣ |
| B.MnS难溶于水,可溶于MnCl2溶液中 |
| C.常温时,CuS、PbS、CdS比MnS更难溶 |
| D.加入MnS后生成CuS的离子方程式是Cu2++S2﹣=CuS↓ |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积KSP(25℃)如下:
| |
AgCl |
Agl |
Ag2S |
| KSP(单位省略) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列论述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不相同
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是( )
| A.AgCl的悬浊液中通入少量HCl,c(Ag+)减小 |
| B.AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360 |
| C.AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成 |
| D.等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀 |
已知溶液中存在平衡:Ca(OH)2 (s)  Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
| A.升高温度,固体的量减少 |
| B.加入少量Na2CO3粉末能增大钙离子的浓度 |
| C.降低温度,溶液中c(OH-)增大 |
| D.恒温下加入少量CaO,溶液的pH增大 |
室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
A.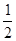 lg( lg(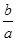 ) ) |
B.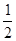 lg( lg(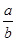 ) ) |
C.14 + 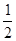 lg( lg(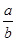 ) ) |
D.14 + 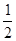 lg( lg(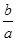 ) ) |
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2﹣最低浓度的对数值lgc(S2﹣)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
| A.25℃时K(CuS)约为1×10﹣35 |
| B.向100mLZn2+、Cu2+浓度均为10﹣5mol•L﹣1的混合溶液 中逐滴加入10﹣4mol•L﹣1的Na2S溶液,Cu2+先沉淀 |
| C.Na2S溶液中:c(S2﹣)+c(HS﹣)+c(H2S)═2c(Na+) |
| D.向Cu2+浓度为10﹣5mol•L﹣1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
工业上向锅炉里注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3而后用盐酸去除。下列叙述不正确的是
| A.温度升高,Na2CO3溶液的Kw和c(OH一)均会增大 |
| B.沉淀转化的离子方程式为CO32-+CaSO4=CaCO3+SO42- |
| C.盐酸溶液中,CaCO3的溶解性大于CaSO4 |
| D.Na2CO3溶液遇CO2后,阴离子浓度均减小 |
下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.5×10-16 |
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
己知Ksp(AgCl) =1.56×10-10,Ksp(AgBr) =7.7×10-13,Ksp(Ag2CrO4)=9×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.0l0mol/L,向该溶液中逐滴加入0.0l0mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
常温时,M(OH)2的Ksp=4×10-6,将0.32mol/L的MCl2溶液与pH为12的氨水等体积混合,有关叙述不正确的是( )
| A.混合溶液中的Cl-离子浓度为0.32mol/L |
| B.混合后溶液中c (NH4+)/c (NH3·H2O)比值变小 |
| C.混合溶液对于M(OH)2为饱和溶液 |
| D.会有M(OH)2沉淀生成 |
试题篮
()