理论上不能用于设计成原电池的反应是( )
| A.2H2(g)+O2(g)=2H2O(l)ΔH<0 |
| B.2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l)ΔH<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g) = 4 Fe(OH)3(s)ΔH<0 |
| D.HCl+NaOH= NaCl+H2OΔH<0 |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:
Zn +2OH--2e-= Zn(OH)2 Ag2O+ H2O+ 2e-= 2Ag +2OH- 下列说法正确的是:( )
| A.溶液中OH-向正极移动,K+、H+向负极移动 |
| B.锌发生还原反应,氧化银发生氧化反应 |
| C.锌是负极,氧化银是正极 |
| D.在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
下列说法中正确的是
| A.原电池是把电能转化为化学能的装置 |
| B.原电池中电子流出的一极是正极,发生氧化反应 |
| C.原电池两极均发生氧化还原反应 |
| D.原电池中的阳离子向正极移动 |
铜锌原电池的装置如下图所示,下列叙述不正确的是
| A.溶液中的H+定向移动到正极 |
| B.铜片逐渐溶解,质量减轻 |
| C.锌片为负极 |
| D.该装置可以将化学能转化为电能 |
把a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序为
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是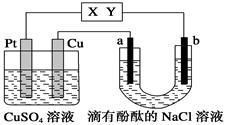
| A.X极是电源的负极,Y极是电源的正极 |
| B.Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体 |
| C.电解过程中CuSO4溶液的pH逐渐增大 |
| D.a极的电极反应式为2Cl--2e-=== Cl2↑ |
理论上不能设计为原电池的化学反应是( )
A.CH4(g)+2O2(g) CO2(g)+2H2O(1);△H<0 CO2(g)+2H2O(1);△H<0 |
B.HNO3(1)+NaOH(1) NaNO3(1)+H2O(1);△H<0 NaNO3(1)+H2O(1);△H<0 |
C.2H2(g)+O2(g) 2H2O(1);△H<0 2H2O(1);△H<0 |
| D.2FeCl3(1)+Fe(s)==3FeCl2(1);△H<0 |
对于原电池的电极名称叙述有错误的是 ( )
| A.发生氧化反应的为负极 | B.正极为电子流入的一极 |
| C.电流的方向由正极到负极 | D.比较不活泼的金属为负极 |
理论上不能用于设计成原电池的反应是( )
| A.HCl+NaOH= NaCl+H2OΔH<0 |
| B.2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l)ΔH<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g) = 4 Fe(OH)3(s)ΔH<0 |
| D.2H2(g)+O2(g)=2H2O(l) ΔH<0 |
在理论上可设计成原电池的化学反应是( )
| A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(l)+8H2O(l) ΔH>0 |
| C.CaC2(s)+2H2O(l)―→Ca(OH)2(s)+C2H2(g) ΔH<0 |
| D.CH4(g)+2O2(g)―→CO2(g)+H2O(l) ΔH<0 |
试题篮
()