研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5 MnO2+2 Ag+2 NaCl=Na2Mn5O10+2 AgCl。下列关于“水”电池的说法不正确的是
| A.AgCl是还原产物 |
| B.负极的电极反应为:Ag+Cl- — e-=AgCl |
| C.Na+不断向“水”电池的正极移动 |
| D.每生成1mol Na2Mn5O10转移2mol电子 |
下列表述不正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 盐桥中的Cl-移向CuSO4溶液 |
a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 |
粗铜的电极反应式为:Cu2++2e-=Cu |
正极反应式为:O2+4e-+2H2O=4OH- |
某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是
| A.正极反应为AgCl+e﹣═Ag+Cl﹣ |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01mol e﹣时,交换膜左则溶液中约减少0.02mol离子 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2 + M =" NiOOH" + MH
已知:6NiOOH + NH3 + H2O + OH-="6" Ni(OH)2 + NO2-
下列说法正确的是
| A.充电过程中OH-离子从阳极向阴极迁移 |
| B.充电过程中阴极的电极反应式:H2O + M + e-="MH" + OH-,H2O中的H被M还原 |
| C.电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为
| A.X>Y>Z>M | B.X>Z>Y>M |
| C.M>Z>X>Y | D.X>Z>M>Y |
铜锌原电池(如图)工作时,下列叙述正确的是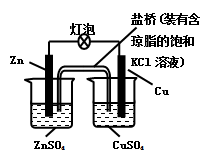
| A.一段时间后,铜棒上有红色物质析出 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.在外电路中,电流从负极流向正极 |
| D.盐桥中的K+移向ZnSO4溶液 |
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述正确的是
| A.还原剂与氧化剂的物质的量之比为1:8 |
| B.该过程说明Fe(NO3)2溶液可加酸酸化 |
| C.若有1mol NO3-发生氧化反应,则转移8mol电子 |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol e- 3H2+CO,每消耗1molCH4转移12mol e- |
| B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
| C.电池工作时,CO32-向电极B移动 |
| D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
| A.锌电极上发生还原反应 |
| B.电池工作一段时间后,甲池的c(SO42﹣)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
C.M电极反应式:  |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |
如图所示的电化学装置,可用于净化处理厕所排放废水中的尿素( H2 NCON H2),同时产生电能。下列有关说法不正确的是
| A.右侧的多孔碳电极是原电池的负极 |
| B.电解质溶液中H十向左侧移动 |
C.正极上发生还原反应: |
| D.电极上消耗标准状况下33.6LO2,电路中转移6 mol电子 |
为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)不变,生成H2量不变 |
| B.加入少量水,v(H2)减小,生成H2量减少 |
| C.加入CH3COONa固体,v(H2)减小,生成H2量不变 |
| D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少 |
在如图中,甲烧杯中盛有100 mL 0.50 mol/L AgNO3 溶液,乙烧杯中盛有100 mL 0.25 mol/L CuCl2溶液,A、B、C、D均为 质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g。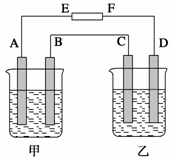
(1)电源E为________极
(2)A极的电极反应式为______________,析出物质______ mol。
(3)B极的电极反应式为______________,析出气体______ mL(标准状况)。
(4)D极的电极反应式为______________,析出气体______ mL(标准状况)。
(5)甲烧杯中滴入石蕊试液,________极附近变红,如果继续电离,在甲烧杯中最终得到______溶液。
MgAgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg ="=" Mg2++2Ag +2Cl-。有关该电池的说法正确的是
| A.可用于海上照明供电 | B.负极反应为AgCl+e-==Ag+Cl- |
| C.Mg为电池的正极 | D.AgCl为阳极,发生了氧化反应 |
试题篮
()