某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是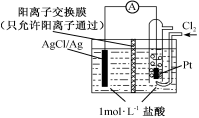
| A.正极反应为AgCl+e-=Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是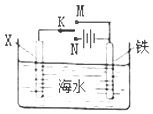
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法 |
| B.若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法 |
| D.若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH- |
下图所示装置的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的阳离子会移向CuSO4溶液 |
| C.正极附近的SO42-离子浓度逐渐增大 |
| D.锌离子在锌片表面被还原 |
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极。实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是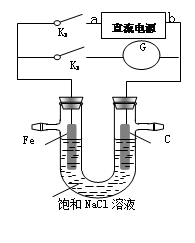
A.断开K1闭合K2时,总反应的离子方程式为:2H++2Cl- H2↑+Cl2↑ H2↑+Cl2↑ |
| B.断开K1闭合K2时,电子沿“a →Fe→电解质溶液→C→b”的路径流动 |
| C.断开K1闭合K2时,铁电极附近溶液pH逐渐升高 |
| D.断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法 |
爱迪生电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,下列该蓄电池推断不正确的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断不正确的是
| A.放电时,Fe参与负极反应,NiO2参与正极反应 |
| B.充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- =" Fe" + 2OH- |
| C.蓄电池的电极必须浸入某种碱性电解质溶液中 |
| D.放电时,电解质溶液中的阴离子向正极方向移动 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
有甲、乙两个装置,下列说法错误的是
| A.甲、乙装置中,Zn的质量均减小 | B.甲、乙装置中,Cu上均有气泡产生 |
| C.化学反应速率 乙 > 甲 | D.甲中H+ 移向Zn,乙中H+ 移向Cu |
右图为一原电池的结构示意图,下列说法中,错误的是
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol e- 3H2+CO,每消耗1molCH4转移12mol e- |
| B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
| C.电池工作时,CO32-向电极B移动 |
| D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
关于下图所示的原电池,下列说法正确的是
| A.电子沿着盐桥从锌电极流向铜电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.电流从锌电极通过电流计流向铜电极 |
| D.铜电极上发生的电极反应是2H++2e-===H2↑ |
磷酸铁锂电池结构如右图所示。左边由LiFePO4晶体组成,铝箔与电池一极连接;中间是聚合物隔膜,锂离子可以通过而电子不能通过;右边由石墨组成,铜箔与电池另一极连接,电池内充满电解质。在充电过程中LiFePO4中的锂离子脱出并伴随着铁元素的氧化。下列说法不正确的是
| A.放电时,铝箔所在电极为负极,铜箔所在电极为正极 |
| B.放电时,电池反应式为:FePO4+Li ="=" LiFePO4 |
| C.充电时, Li+向阴极移动 |
| D.充电时,阳极的电极反应式为:LiFePO4 – e— ="=" FePO4+Li+ |
铅蓄电池放电时的反应:PbO2+Pb+2H2SO4 =2PbSO4+2H2O,下列有关放电时的说法正确的是
| A.PbO2作正极,电极发生氧化反应 |
| B.当转移的电子数为3.01×1023时,参与反应的Pb的质量为103.5 g |
| C.负极的电极反应式是:Pb + SO42- - 2e- =PbSO4 |
| D.溶液中H+移向负极 |
在如图所示的原电池中,下列说法正确的是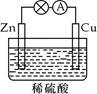
| A.负极发生还原反应 |
| B.正极反应为 Cu-2e-=Cu2+ |
| C.电子由铜片通过导线流向锌片 |
| D.反应一段时间后,溶液的酸性减弱 |
下列各变化中属于原电池反应的是( )。
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,仍然能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
试题篮
()