(16分)已知A、B、C、D是原子序数依次增大的四种短周期元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、D的基态原子的第一电离能由大到小的顺序为 。
(2)M分子中B原子轨道的杂化类型为 。
(3)E+的核外电子排布式为 ,下图是由D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。
(4)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(5)写出与BD2互为等电子体的C3-的结构式 。
(6)微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置.最早用于有机废水处理,下图是利用微生物燃料电池处理含M废水的装置,其中3是质子交换膜.负极所在的左室中发生反应的电极反应式是 。
(7)铁粉和E单质粉末的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO).则稀硝酸的浓度为 mol/L。
| 编号 |
① |
② |
③ |
④ |
| 稀硝酸的体积/mL |
100 |
200 |
300 |
400 |
| 剩余金属的质量/g |
18.0 |
9.6 |
0 |
0 |
| NO的体积/mL |
2240 |
4480 |
6720 |
V |
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)上图两装置中能构成原电池的是 (填甲或乙)。
(2)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子的物质的量为 。
(3)现有如下两个反应:A:NaOH+HCl=NaCl+H2O ;B:Fe+2Fe3+= 3Fe2+,根据两反应的本质,判断 不能设计成为原电池(填A或B),不能的原因是 。
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题。
(1)工业上可用Cu2S+O2 2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:________________.CuSO4溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,则反应后的溶液中肯定有的离子是________________;若有红色固体,则反应后的溶液中肯定没有的离子是________,检验该离子的试剂为________。
(4)铁氰化钾 K3[Fe(CN)5]和亚铁氰化钾K4[Fe(CN)6] 的混合溶液可用于太阳能电池的电解液,该太阳能电池的工作原理示意图如图所示,其中催化剂a为________极,电极反应式为________;
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。

(1)该电池的负极材料是 电池工作时,电子从Zn极流向 填(“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
欲除去Cu2+,最好选用下列试剂中的 (填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液制取,则MnO2在 极产生。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。(MnO2的摩尔质量为:87g/mol)
研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;
(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题: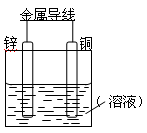
Ⅰ.若电解质溶液为稀硫酸
(1)Zn棒为原电池的 极,其电极反应式为 。
(2)Cu棒为原电池的 极,其电极反应式为 。
Ⅱ.若电解质为硫酸铜溶液,
(3)Cu棒上发生 反应。
(4)若在上述两个过程中,转移电子数相等,则Cu棒上Ⅰ和Ⅱ所析出物质的质量之比为 。
18.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。
请按要求回答相关问题:
(1)甲烷燃料电池负极的电极反应式是 。
(2)石墨电极(C)的电极反应式为 。
(3)在标准状况下,若有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为 L。
(4)在开始一段时间,铜a电极附近溶液中观察到的现象为 。
(5)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 (填字母)。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
依据原电池原理,回答下列问题:
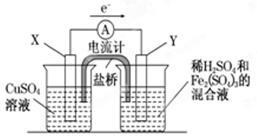
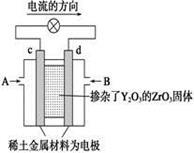
图(1) 图(2)
(1)图(1)是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料为是 ;电极Y的材料为是 。
②Y电极发生的电极反应式为: 。
(2)图(2)是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e―→2O2-)。
① c电极的名称为 ②d电极上的电极反应式为 。
水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)由水煤气可以合成甲醇(CH3OH)。已知0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出CH3OH(l)燃烧的热化学方程式 。
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。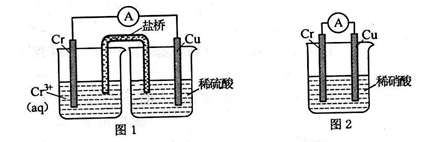
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。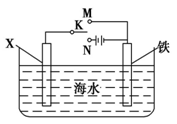
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
仔细观察下图,根据题意对图中两极进行必要的连接后填空:
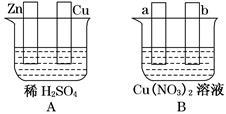
(1)若在图A中,使铜片上冒H2气泡。则加以必要的连接后的装置叫 。
(2)若在图B中,a、b为惰性电极,进行必要的连接后使b极析出1.28g铜,则a极析出的物质的物质的量为 ,反应的总反应方程式为 。
(3)若将图A中Zn、Cu两极与图B中a、b作必要的边接后,也能产生与(1)、(2)完全相同的现象,则Cu极连_______极(填a或b)。经过一段时间后,停止反应并搅匀溶液,图B中溶液的pH_________(填写“升高”、“降低”或“不变”),欲使溶液恢复至与反应前完全一致,则应加入的一定量的物质是_________。
| A.CuO | B.Cu(OH)2 | C.Cu2(OH)2CO3 | D.CuCO3 |
大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱硝)后才能排放。
(1)已知:
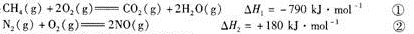
CH4可用于脱硝,其热化学方程式为:

已知反应①中的相关的化学键键能数据如下:

由此计算△H3= kJ·mol-1,C-H化学键键能E= kJ·mol-1。
(2)反应2CO(g) +2NO(g)=N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=__ ,图中压强(P1、P2、P3)的大小顺序为_____________。

(3)有人利用电化学方法将CO和NO转化为无毒物质。装置如图2所示
①电极a是 极;②电极b的电极反应式是 。
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO。的体积分数下降,其可能的原因是__________。研究小组通过增大 比值提高NO的平衡转化率,却发现当
比值提高NO的平衡转化率,却发现当 >1时,NO2的物质的量减小,可能原因是________________。
>1时,NO2的物质的量减小,可能原因是________________。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g) △H>O
HCOOCH3(g)+2H2(g) △H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g) △H>O
CH3OH(g)+CO(g) △H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。
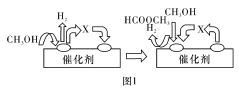
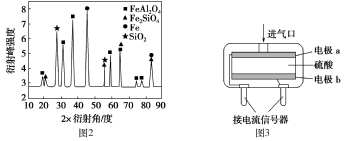
(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。
(10分,每空2分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池,已知H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1、-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解180 g水消耗的能量是 kJ。
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃):
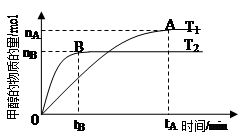

下列说法正确的是 (填序号)
①温度为T1时,从反应开始到平衡,甲醇的平均速率为v(CH3OH)=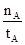 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时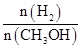 增大
增大
(4)在T1温度时(甲醇为气态),将lmol CO2和3mol H2充入一密闭恒容容器中充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为 。
(10分) (Ⅰ)观察图A、B、C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) 、 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3mol•L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是 。
试题篮
()