短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。

(1)写出W的原子结构示意图: 。
(2)将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3)已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4)ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5)利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式___________。
(6)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。

①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)=_______________。
天然矿物芒硝化学式为Na2SO4·10H2O,为无色晶体,易溶于水。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。

(1)该电解槽的阴极电极反应式为 。此时通过阴离子交换膜的离子数__________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)所得到的浓氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)________导出。
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则该电池负极的电极反应式为____________________。
(共9分)如图所示,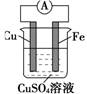
(1)该装置叫_____装置,可以将_____能转化为_____能。
(2)负极是 _______,电极反应为_______。
(3)正极是_______,电极反应为__ ,总反应为____。
对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
(1)25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 。
(2)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。

(3)1600℃时,反应2CO(g)+ O2(g) 2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应式 。
C、O、Na、Al、S、Cl是常见的六种元素。
(1)C元素位于元素周期表第 周期,第 族;C元素的一种中子数为8同位素的符号为 。
(2)用“大于”“小于”或“等于”填空
| 离子半径 |
酸性 |
还原性 |
得电子能力 |
| N3- Al3+ |
H2SO4 HClO4 |
O2- S2- |
35Cl 37Cl |
(3)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示。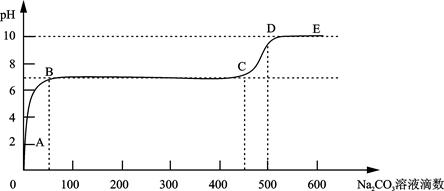
请用离子方程式表示B-C段发生的反应: 。
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式 。
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下: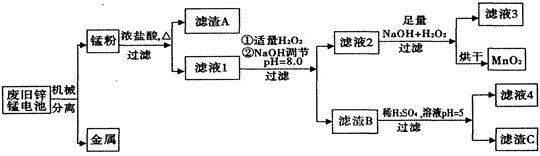
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 / Mn(OH)3 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH(c≤1.0×10-5mol/L) |
3.7 |
9.6 |
8.0 |
8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是____________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能否设计成原电池:A、_________,B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因___________________________________________;
(3)如果可以,则写出正、负极材料及其电极反应式, 电解质溶液:
负极材料________,电极反应式_______________,电解质溶液____________;
正极材料________,电极反应式_______________。
如图是某同学设计的一个简易的原电池装置,回答下列问题。
(1)若a为镁、b为CuCl2,则正极材料为_____,负极上的电极反应式为_________。
(2)若a为镁、b为NaOH,则Mg极上发生________反应(填“氧化”或“还原”),负极上的电极反应式为_______________。
(3)若a为铜、b为浓硝酸,则电流的方向为____→___(填电极材料),正极上的电极反应式为______。
(4)上述事实表明,确定原电池中电极的正负时,不仅要考虑电极材料本身的性质,还要考虑________。
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:
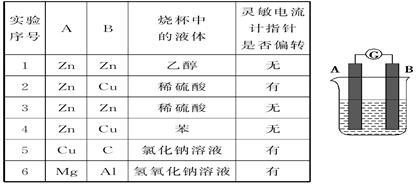
分析上述实验,回答下列问题:
(1)实验2中电流由________极流向________极(填“A”或“B”)。
(2)实验6中电子由B极流向A极,表明负极是__________(填“镁”或“铝”)电极。
(3)实验5表明____________。
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________。
A.相对活泼的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属导体)
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。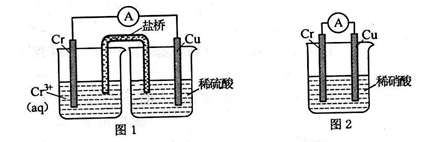
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。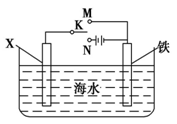
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
仔细观察下图,根据题意对图中两极进行必要的连接后填空:
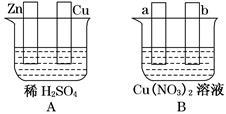
(1)若在图A中,使铜片上冒H2气泡。则加以必要的连接后的装置叫 。
(2)若在图B中,a、b为惰性电极,进行必要的连接后使b极析出1.28g铜,则a极析出的物质的物质的量为 ,反应的总反应方程式为 。
(3)若将图A中Zn、Cu两极与图B中a、b作必要的边接后,也能产生与(1)、(2)完全相同的现象,则Cu极连_______极(填a或b)。经过一段时间后,停止反应并搅匀溶液,图B中溶液的pH_________(填写“升高”、“降低”或“不变”),欲使溶液恢复至与反应前完全一致,则应加入的一定量的物质是_________。
| A.CuO | B.Cu(OH)2 | C.Cu2(OH)2CO3 | D.CuCO3 |
大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱硝)后才能排放。
(1)已知:
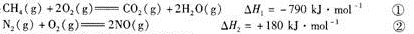
CH4可用于脱硝,其热化学方程式为:

已知反应①中的相关的化学键键能数据如下:

由此计算△H3= kJ·mol-1,C-H化学键键能E= kJ·mol-1。
(2)反应2CO(g) +2NO(g)=N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=__ ,图中压强(P1、P2、P3)的大小顺序为_____________。

(3)有人利用电化学方法将CO和NO转化为无毒物质。装置如图2所示
①电极a是 极;②电极b的电极反应式是 。
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO。的体积分数下降,其可能的原因是__________。研究小组通过增大 比值提高NO的平衡转化率,却发现当
比值提高NO的平衡转化率,却发现当 >1时,NO2的物质的量减小,可能原因是________________。
>1时,NO2的物质的量减小,可能原因是________________。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g) △H>O
HCOOCH3(g)+2H2(g) △H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g) △H>O
CH3OH(g)+CO(g) △H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。
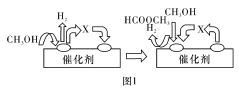
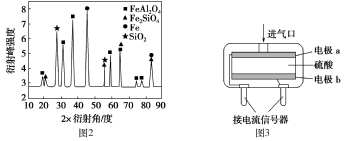
(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。
(10分,每空2分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池,已知H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1、-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解180 g水消耗的能量是 kJ。
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃):
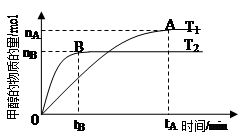

下列说法正确的是 (填序号)
①温度为T1时,从反应开始到平衡,甲醇的平均速率为v(CH3OH)=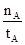 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时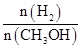 增大
增大
(4)在T1温度时(甲醇为气态),将lmol CO2和3mol H2充入一密闭恒容容器中充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为 。
(10分) (Ⅰ)观察图A、B、C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) 、 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3mol•L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是 。
试题篮
()