常见的纽扣电池为Ag Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn
Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn Hg合金作负极的活性材料,电解质溶液为浓KOH溶液。写出此电池的正极和负极反应式以及电池总反应式。
Hg合金作负极的活性材料,电解质溶液为浓KOH溶液。写出此电池的正极和负极反应式以及电池总反应式。
有人设计以Pt和Zn为电极材料,埋入人体作某种心脏起搏器的能源。它依靠人体内体液中含有一定物质的量浓度的溶解氧、H+和Zn2+进行工作。试写出两极反应的方程式。
氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为 (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G  N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为: 。
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为: (选填“A”或“B”),阴极反应式为: 。
运用化学反应原理研究碳、氮、硫、氯等单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)下列措施中,不利于环境保护的有 (填编号)。
a.大量开采使用化石燃料
b.使用无氟冰箱、空调
c.多步行多乘公交车,少用专车和私家车
d.将工业“废气”、“废液”、“废渣”直接排放
(2)工业上的“脱碳”指的是从“脱硝”、“脱硫”后的烟气用碱液吸收并得到浓缩的二氧化碳。利用二氧化碳合成甲醇是碳减排的新方向。
①写出吸收二氧化碳的离子方程式 。
②常温下,0.1mol/LNaHCO3溶液的pH>8,则溶液中c(H2CO3) _______c(CO32-) (填“>”、“<”或“=”)。
③合成的甲醇可以做为新型燃料电池的原料,若电解液是碱性的,则其负极的电极反应式为 。
(3)二氧化氯(ClO2),为一种黄绿色气体,是公认的高效、广谱安全的杀菌消毒剂。工业上制备ClO2的反应原理为:4HC1(浓)+2NaClO3=2ClO2↑+Cl2↑+2H2O+2NaCl。上述反应中,产生1 mol ClO2,则被氧化的HC1为 。
(4)SO2溶于水可以得到二元弱酸H2SO3(亚硫酸)。
①25℃时,将NaOH深液与亚硫酸混合至恰好中和,则混合液中各种离子浓度的大小关系为 。
②25℃时,当NaOH溶液与H2SO3等物质的量混合时,发现混合液pH<7,请你简要解释其原因 。
硫及其化合物在自然界中广泛存在,运用相关
原理回答下列问题:
(1)如图表示一定温度下,向体积为10L的密闭容器中充入1molO2和一定量的SO2后,SO2和SO3(g)的浓度随时间变化的情况。
①该温度下,从反应开始至平衡时氧气的平均反应速率是 ;
②该温度下,反应2SO2(g)+O2(g)  2SO3(g)的平衡常数为 。
2SO3(g)的平衡常数为 。
(2)以黄铜矿(主要成分CuFeS2)为原料,经焙烧、熔炼等使铁元素及其他有关杂质进入炉渣,将铜元素还原为铜。发生的主要反应为:
2Cu2S(s)+3O2(g) = 2Cu2O(s)+2SO2(g) △H ="-768.2" kJ·mol-1
2Cu2O(s)+ Cu2S (s) = 6Cu(s)+SO2(g) △H ="+116.0" kJ·mol-1
①“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,该反应的化学方程式为: 。
②在熔炼中,Cu2S与等物质的量的O2反应生成Cu的热化学方程式为: 。
(3)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有__________(填化学式)。
(2)已知:2SO2(g)+ O2(g)=2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)=2NO2(g);△H=-113.0kJ/mol
①反应:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=_ kJ/mol。
②一定条件下,将NO2和SO2以体积比1:1置于恒温恒容的密闭容器中发生反应: NO2(g) +SO2(g) SO3(g) +NO(g),
SO3(g) +NO(g),
下列不能说明反应达到平衡状态的是_____(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
①上述合成甲醇的反应为______(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_____L。
(4)某研究小组设计了如图所示的甲醇燃料电池装置。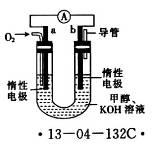
①该电池工作时,OH-向______(填“a”或“b”)极移动。
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为__________________。
硼及其化合物在耐髙温合金工业、催化剂制造、髙能燃料等方面应用广泛。
(1)氮化硼是一种耐高温材料,巳知相关反应的热化学方程式如下:
2B(s)+N2(g)= 2BN(s) ΔH="a" kJ • mol-1
B2H6 (g)=2B(s) + 3H2 (g) ΔH =b kJ • mol-1
N2 (g) + 3H2 (g) 2NH3 (g) ΔH ="c" kJ• mol-1
2NH3 (g) ΔH ="c" kJ• mol-1
①反应B2H6(g)+2NH3(g)=2BN(s)+6H2(g) ΔH = (用含a、b、c的代数式表示)kJ ·mol-1。
②B2H6是一种髙能燃料,写出其与Cl2反应生成两种氯化物的化学方程式: 。
(2)硼的一些化合物的独特性质日益受到人们的关注。
①最近美国化学家杰西·萨巴蒂尼发现由碳化硼制作的绿色焰火比传统焰火(硝酸钡)更安全,碳化硼中硼的质量分数为78. 6%,则碳化硼的化学式为 。
②近年来人们将LiBH4和LiNH2球磨化合可形成新的化合物Li3BN2H8和Li4BN3 H10,Li3BN2H8球磨是按物质的量之比n(LiNH2) : n(LiBH4) =" 2" : 1加热球磨形成的,反应过程中的X衍射图谱如图所示。
Li3BN2H8在大于250℃时分解的化学方程式为 ,Li3BN2H8与Li4BN3H10的物质的量相同时,充分分解,放出等量的H2,Li4BN3 H10分解时还会产生固体Li2NH和另一种气体,该气体是 。
(3)直接硼氢化物燃料电池的原理如图,负极的电极反应式为 。电池总反应的离子方程式为 。
(1)在室温下测得0.1mol·L-1氨水PH=11,则该温度下氨水的电离度 =__________
=__________
(2)25℃时在0.1mol·L-1的H2A水溶液中,用氢氧化钠来调节溶液的pH,得到其中含H2A、HA-、A2-三种微粒的溶液。
①当溶液的pH=7时,c(Na+)=__________(填微粒间量的关系)
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时溶液为__________溶液(填物质)。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和液态水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是__________。
(4)甲醇—空气燃料电池是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH+3O2=2CO2+4H2O。其工作原理示意图如下(其中a、b、c、d四个出入口表示通入或排出的物质)。
则负极的电极反应式为__________;正极的电极反应式为__________
试题篮
()