将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
钢铁发生腐蚀时,正极上发生的反应是
| A.2Fe-4e- = 2Fe2+ | B.2Fe2++4e- = 2Fe |
| C.2H2O+O2+4e-= 4OH- | D.Fe3++e-= Fe2+ |
市场上出售的“热敷带”的主要成分是铁屑、碳粉、木屑、少量的氯化钠、水等。“热敷带”启用之前用塑料袋密封,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会产生大量铁锈。
(1)“热敷带”放热的原理是:______________________________________________
(2)碳粉的作用是: 氯化钠的作用是:_____________________________
(3)有关电极反应是:________________________________________________________
随后反应为:_____________________________________________________________
硫一钠原电池具有输出功率较高、循环寿命长等优点。其工作原理可表示为: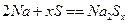 。但工作温度过高是这种高性能电池的缺陷。科学家研究发现,采用多硫化合物[如
。但工作温度过高是这种高性能电池的缺陷。科学家研究发现,采用多硫化合物[如 ]作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是
]作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是
| A.这是一种新型无机非金属材料 |
| B.此化合物可能发生加成反应 |
C.原电池的负极反应将是单体 转化为 转化为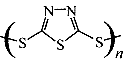 t的过程 t的过程 |
| D.当电路中转移0.02mol电子时,将消耗原电池的正极反应材料1.48g |
有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH====K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e-==CO32-+7H2O
D.放电一段时间后,溶液的pH升高
下列反应不可用于设计原电池的是
| A.NaOH+HCl=NaCl+H2O | B.2CH3OH+3O2→2CO2+4H2O |
| C.Zn+2HCl====ZnCl2+H2 | D.4Al+3O2+6H2O====4Al(OH)3 |
根据所学知识回答下列问题,在如图所示装置中 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 ,正极反应式为 ,负极反应式为 ,
该装置中的能量变化形式为 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,装置中总反应方程式为 。
从07年的“嫦娥奔月”到08年的“神七问天”,中国航天事业一次又一次取得了骄人战绩。这些人造卫星在宇宙中运行的能量来源于太阳的光能,其原理是:一定条件下光解水得到H2、O2,然后H2、O2在一定条件下形成氢氧燃料电池,两个过程循环往复。下列关于该氢氧燃料电池的说法中正确的是 ( )
A.其总反应为: 2H2+O2 2H2O 2H2O |
| B.若电解质为稀H2SO4,则负极反应式为4H++4e-= 2H2 |
| C.若电解质为NaOH溶液,则正极反应式为2H2O+O2+4e-= 4OH- |
| D.该电池反应的实质不同于H2在O2中燃烧 |
试题篮
()