如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
下列叙述正确的是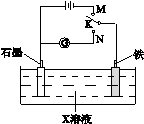
| A.K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e- = H2↑ |
| C.K与M连接时,X为氯化钠,石墨电极反应:4OH- -4e- =2H2O+O2↑ |
| D.K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
关于下列各图的说法,正确的是
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
用指定材料做电极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组是:
| |
阳极 |
阴极 |
溶液甲 |
物质乙 |
| A. |
Pt |
Pt |
NaOH |
NaOH固体 |
| B. |
Pt |
Pt |
H2SO4 |
H2O |
| C. |
C |
Fe |
NaCl |
盐酸 |
| D. |
粗铜 |
精铜 |
CuSO4 |
Cu(OH)2 |
将含有0.400molCuSO4和0.200molKCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上析出19.2gCu,此时在另一电极上放出的气体在标准状况下的体积为( )
| A.5.60L | B.6.72L | C.4.48L | D.3.36L |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中两极产生气体的总物质的量为
| A.0.1 mol | B.0.2 mol | C.0.3 mol | D.0.4 mol |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是 
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-===Fe(OH)2 |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-===H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2mol Fe(OH)3沉淀。此过程中共消耗水( )
| A.3mol | B.4mol | C.5mol | D.6mol |
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是
| A.稀NaOH溶液 | B.HCl溶液 |
| C.酸性MgCl2溶液 | D.酸性AgNO3溶液 |
1L0.1mol·L—1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发) ( )
| A.溶液的浓度变为0.08mol·L—1 | B.阳极上产生112mLO2(标准状况) |
| C.转移的电子数是l.204×1022个 | D.反应中有0.01mol的Ag被氧化 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是( )
| A.放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3 -3e—+ 5OH—=FeO42-+ 4H2O |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
下列叙述正确的是( )
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
利用电解法可将含有、
、
、
等杂质的粗铜提纯,下列叙述正确的是()
| A. | 电解时以纯铜作阳极 |
| B. | 电解时阴极发生氧化反应 |
| C. |
粗铜连接电源负极,电极反应是
|
| D. |
电解结束,电解槽底部会形成含少量
|
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是 ( )


A.a为负极、b为正极 |
B.a为阳极、b为阴极 |
C.电解过程中,氯离子浓度不变 |
D.电解过程中,d电极质量增加 |
试题篮
()