用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
| A.CuSO4 | B.Na2SO4 | C.CuCl2 | D.NaCl |
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为_______ B池为______
(2)锌极为______极,电极反应式为______________
铜极为______极,电极反应式为______________
石墨棒C1为_____极,电极反应式为__________
石墨棒C2为_____极,附近发生的实验现象为_____________
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化(增加或减少)____、_____g,CuSO4溶液的质量变化了(增加或减少了)_____、____g
Ⅰ.可逆反应:A(g)+3B(g) 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
(1)这时B的浓度为________mol/L,C的浓度为________mol/L。
(2)这段时间内反应的平均速率若以D的浓度变化来表示,应为________mol/(L·min)。
(3)如果保持容器内温度不变,反应前和反应后容器内压强之比为_____(最简整数比)。
Ⅱ.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题: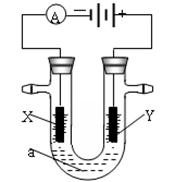
(4)在X极附近观察到的实验现象是:放出气体且______________。检验Y电极反应产物的方法是:把__________________放在Y电极附近,试纸变蓝色。
(5)当通过电解池通过1 mol电子时,两极共收集到________L气体(标准状况),电解池内的液体稀释到500 mL时,NaOH溶液浓度为________mol/L。
如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是
A.电源B是负极
B.甲乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1︰2︰2︰2
C.欲用丙装置给铜镀银,H应该是Ag,电镀液选择AgNO3溶液
D.装置丁中X极附近红褐色变浅,说明氢氧化铁胶粒吸附正电荷
下列叙述正确的是
| A.电镀时应把镀件置于电解槽的阳极 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.目前已经研制成功铝—空气电池,铝为电池的负极 |
| D.原电池的负极和电解池的阳极所发生的反应同属还原反应 |
用石墨作电极,电解下列物质的水溶液,实质上与电解水一致的是
| A.NaOH | B.NaCl | C.CuSO4 | D.CuCl2 |
惰性电极电解饱和食盐水,当溶液中有1mol NaOH生成时,则下列说法不正确的是
| A.阴极析出氢气 |
| B.标准状况下,阴极产生的气体为11.2L |
| C.阳极的电极反应式:2H2O + 2e- = 2OH-+ H2↑ |
| D.电路中有1mol电子通过 |
电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和CuSO4溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
②在Y电极附近观察到的现象是
(2)若X、Y都是铜电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后X电极上有12.8g铜析出,此时直流电源已输出 mol电子。
(3)用石墨电极电解100mLH2SO4和CuSO4混合液,通电一段时间后,两极各出现气体3.36L(标准状况),求原来溶液中CuSO4的浓度 。
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是:
| A.铅笔端作阳极,发生还原反应 | B.铂片端作阴极,发生氧化反应 |
| C.铅笔端有少量的氯气产生 | D.a点是负极,b点是正极 |

近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O KIO3 + 3H2↑。下列有关说法正确的是( )
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –+ 3H2O → IO3 – + 6H++ 6e – |
| C.阳极发生了还原反应 |
| D.电解前后溶液的pH明显减小 |
某实验小组利用饱和食盐水、导线、直流电源(用“ ” 或“
” 或“ ”表示)、烧杯、灵
”表示)、烧杯、灵
敏电流计(用“ ”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象产生,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。
请根据上述同学的实验现 象回答以下问题:
象回答以下问题:
(1)M电极棒材料是(写化学式) ,N电极棒材料是(写化学式) 。
(2)在下列虚框内完成对应三个同学的装置图:
(3)按要求写出三个同学实验过程中涉及的反应方程式:
甲同学N电极方程式
乙同学总反应的离子方程式
丙同学N电极方程式
(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因:
 。
。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式) 。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3[Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是 。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为 极;
(2)写出电解前后各溶液的pH变化情况(增大、减小或不变 ):
):
甲溶液 ;乙溶液 ;丙溶液 ;
(3)电极b上生成的气体在标准状态下的体积是 ;
电极c的质量变化是 g。
常温下用铂电极电解2L含KCl和KNO3的混和溶液一段时间,若导线上通过了n mol电子的电量,电解前后溶液的体积变化忽略不计,则溶液中pH与n的关系是( )
A.pH=-lg |
B.pH=14+lg |
C.pH="-lg2n" | D.pH=14-lg |
请按要求完成下列反应的式子。
(1)银锌纽扣电池(总反应:Ag2O+Zn= 2Ag+ZnO,电解质溶液:氢氧化钾)的正极反应:______________________________________________________
(2)电解以下溶液:
A. 当电解质溶液为硝酸银溶液、阳极材料为银、阴极材料为铜的阳极反应:______________________________________________________
B. 当电解质溶液为氯化钠溶液、阳极阴极材料均为石墨的阴极反应:
______________________________________________________
C. 将A中的阳极材料改为石墨,其它条件不变时的电解总反应:
______________________________________________________
(3)请你任选一种离子,这种离子既能电离又能水解,分别写出其电离与水解的离子方程式:
电离:______________________________________________________
水解:______________________________________________________
(4)已知每分解1g NH4NO3晶体放出0.53 kJ(298K,101KPa)热量,同时生成笑气(N2O)与液体水。请根据上述信息写出NH4NO3晶体分解的热化学方程式:______________________________________________________
试题篮
()