电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
a.电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
b.Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
a .X电极的材料是 ,电极反应式是 。
b.Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
(10分)如图所示:已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。甲池是 装置,乙池是 装置。
(2)B(石墨)电极的名称是 。在图中标明电子移动的方向。
(3)通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
氯碱工业中电解饱和食盐水的原理示意图如下图所示: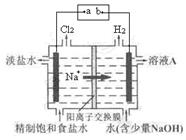
(1)电极a是电源的 。
(2)溶液A的溶质是(填化学式) 。
(3)电解饱和食盐水的离子方程式是 。
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 _______________________________________________________ 。
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有① Na2CO3溶液② BaCl2 溶液③ NaOH溶液④ HCl,加入试剂的顺序是________________。
A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题:
(1)写出三种强电解质的化学式:A ;B ;C 。
(2)写出乙烧杯c电极发生的电极反应为__________________________,甲烧杯中的总反应的化学方程式为___________________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为________________,甲烧杯中溶液的pH= 。(假设溶液体积是400ml)
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_____________,其质量为 。
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为________________________________
____________________,M级附近溶液的pH (选填“升高”或“降低”或“不变”)。
铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有 mol。
(10分)在常温常压下,都用惰性材料作电极.分别电解(同浓度、同体积、通过相同电量)下列溶液:
| A.CuSO4 | B.AgNO3 | C.KOH | D.H2SO4 E.NaCl F.Na2SO4 |
通电一段时间切断电源,请填写下列空白。
(1)在A中一个电极上质量增加了0.128 g,在B中一个电极上质量增加 ,增加的物质是 .
(2) 在一极产生O2,同时另一极产生H2(填写序号,下同).
(3) 电解后,溶液中的C(OH-)增大
(4) 电解后,溶液的pH减小.
(5) 电解后,溶液的浓度增大而[H+]不变.
电解原理在化学工业上有着广泛的应用。图中电解池a为电解液,X和Y是两块电极板。则:
(1)若X和Y均为惰性电极,a为饱和的NaCI溶液,则电解时检验Y电极反应产物的方法是 。
(2)若X、Y分别为石墨和铁,A乃为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象为 。
(3)若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
(14分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为 ,在X极附近观察到的现象是: ;Y电极上的电极反应式是 。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 ,电极反应式是 ,Y电极的材料是 ,电极反应式是 。
如图所示,通电5 min后,电极5的质量增加了2.16 g,回答:
(1)电源:a是________极,C池是________池。
A池阳极电极反应式为__________________,阴极电极反应式为__________________。
C池阳极电极反应式__________________,阴极电极反应式为_____________________。
(2)如果B槽中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______________________。
(3)如果A池溶液也是200 mL(电解过程中溶液体积不变),则通电后,溶液的pH为[________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中
①X极上的电极反应式为 ,在X极附近观察到的现象是 。
②Y极上的电极反应式为 ,检验该电极反应产物的方法是 。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6 g。请回答下列问题:
(1)B电极发生反应的电极反应式_________________________。
(2)写出电解时反应的离子方程式_________________________________________。
(3)电解后溶液的H+的物质的量浓度为________,要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________g。(假设电解前后溶液的体积不变)
(4)原溶液中可能含有的酸根离子为( )
A CO32- B Cl- C SO42-
设计实验检验该酸根离子,写出操作步骤,实验现象和实验结论________________________
(1)电镀时,镀件与电源的极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用(填"氧化剂"或"还原剂")与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法:

(3)酸浸法制取硫酸铜的流程示意图如下

① 步骤(i)中发生反应的化学方程式为。
② 步骤(ii)所加试剂起调节 作用的离子是(填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol 转移2 mol 电子,该反应的离子方程式为。
④ 步骤(iv)除去杂质的化学方程式可表示为:
过滤后母液的 ,
,
,
,该反应的平衡常数K=(用含a 、b 、d 的代数式表示)。
(11)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: 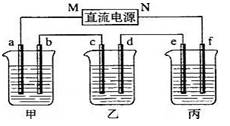
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ; 乙溶液 ; 丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 。
在如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16 g,试回答:
(1) 电源电极X为________极。
(2) pH变化:A________,B________,C________。(填“增大”、“减小”或“不变”)
(3) 通电5 min时,B中共收集224 mL气体(标准状况),溶液体积为200 mL。则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4) 若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为________(设电解前后溶液体积无变化)。
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
(1)电极A的名称是
(2)甲装置中电解反应的总化学方程式是
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
电浮选凝聚法是工业上采用的一种污水处理方法下图是电解污水装置示意图。
(1)根据污水净化原理写出阳极和阴极的电极反应:
阳极:_____________________,_________________,____________________。
阴极:______________________________。
(2)分析最后底层积聚的一层沉渣是如何沉淀的:__________________________________ __。
(3)一些悬浮物是怎样形成浮渣的:___________________________________________________。
试题篮
()