短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂,制备ClO2的新工艺是电解法。
(1)如图表示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:__________________________________;图中b电极为_____________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________________。
液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) DH =" +" a kJ·mol-1
N2 (g) + 3H2(g) DH =" +" a kJ·mol-1
请回答下列问题:
(1)已知:2H2 (g) + O2 (g) =2H2O(l) DH =" -" b kJ·mol-1
NH3 (g)  NH3(l) DH =" -" c kJ·mol-1
NH3(l) DH =" -" c kJ·mol-1
则4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) 的DH = kJ·mol-1。
(2)水能发生电离:2H2O(l)  H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
(3)实验室用Pt电极对液氨进行电解可以得到H2和N2 ,若电解过程中阳极收集得到4.48L气体(标况),则转移的电子的数目是 ,标准状况下阴极得到的气体的质量为 g。
仔细观察下图,根据题意对图中两极进行必要的连接后填空:
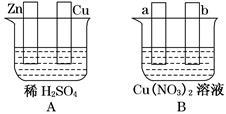
(1)若在图A中,使铜片上冒H2气泡。则加以必要的连接后的装置叫 。
(2)若在图B中,a、b为惰性电极,进行必要的连接后使b极析出1.28g铜,则a极析出的物质的物质的量为 ,反应的总反应方程式为 。
(3)若将图A中Zn、Cu两极与图B中a、b作必要的边接后,也能产生与(1)、(2)完全相同的现象,则Cu极连_______极(填a或b)。经过一段时间后,停止反应并搅匀溶液,图B中溶液的pH_________(填写“升高”、“降低”或“不变”),欲使溶液恢复至与反应前完全一致,则应加入的一定量的物质是_________。
| A.CuO | B.Cu(OH)2 | C.Cu2(OH)2CO3 | D.CuCO3 |
氨气在生产、生活和科研中应用十分广泛 。
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ/mol
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ/mol
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=_____________kJmol。
②液氨可以发生电离:2NH3(l) NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
(2)氨气易液化,便于储运,可利用NH3作储氢材料已知:2NH3(g) N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
①氨气自发分解的反应条件是________________(填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度 的变化如图所示。

在600℃时催化效果最好的是________________(填催化剂的化学式)。c点氨气的转化率高于b点, 原因是________________。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式:________________。
②写出第二步反应的化学方程式:__________________。
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是____________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是__________。
② 电解过程阳极室溶液pH的变化是____________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理____________。
(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) =" CO(g)" + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) =" NaC1(aq)" + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式__________。
(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则

① 若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH=_______________(假设电解后溶液体积不变)。
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
(1)氯原子结构示意图是 ,碘在元素周期表中的位置是 ,HI的稳定性比HBr (填写“强”或“弱”)。
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2。再用“空气吹出法” 将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等。当有1 mol Br2被纯碱吸收时,转移的电子数为 。
下图是NaClO的发生装置。该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻。
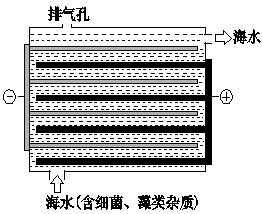
(3)写出装置中产生NaClO的化学方程式 。海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH) 2和CaCO3。 生成CaCO3的离子方程式是 。若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2。在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
(4)从上表可判断,NaHSO3溶液呈 (填“酸性”、“碱性”、“中性”),请用平衡原理解释: 。
(5)当吸收液呈中性时,溶液中离子浓度关系正确的是 (选填字母)。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为 (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G  N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为: 。
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为: (选填“A”或“B”),阴极反应式为: 。

亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
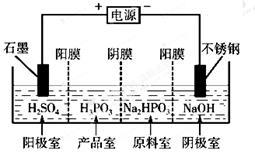
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。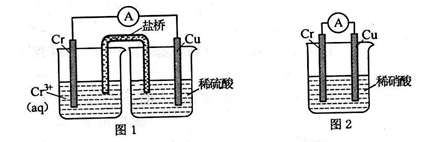
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。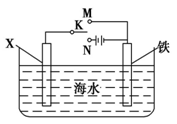
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________(填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______(填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________极(填“正”“负”“阴”或“阳”),其电极反应式为___________。

I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红色锈斑。请回答:
写出铁锅腐蚀时正极的电极反应式: 。
II.氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用平衡移动移动原理解释盐酸的作用: 。
Ⅲ.(1)按右图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式: ;

(2)将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的(3)现象是 。
如图所示的电解装置中,乙池盛有200mL饱和CuSO4溶液,丙池盛有200mL饱和NaCl溶液.通电一段时间后,C极增重0.64g,则:

(1)P是电源的_________极。甲池中,A极的质量_________g。电解一段时间,甲池溶液的pH为_________。(2)D极的电极反应式为 ,丙池电解反应的总离子方程式为 。
相同状况下,D电极与E电极产生的气体体积比为_______________。
(3)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为__________________。(用NA表示)
NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等。
(1)铵态氮肥NH4NO3________(填“能”或“不能”)与草木灰混合施用,用盐类水解的知识简述原因__________。
(2)NH4NO3受热分解温度不同,分解产物也不同。在185~200°C时,NH4NO3分解生成笑气(N2O)和水,分解生成的氧化产物与还原产物的质量比为__________。超过400°C,NH4NO3剧烈分解生成N2、NO2和H2O,并发生爆炸,若32g NH4NO3爆炸放出12.3 kJ的热量,则NH4NO3分解爆炸的热化学方程式为______________。
(3)电解NO制备 NH4NO3,其工作原理如图所示,阴极反应式为___________________;电解反应的总方程式为___________________;为使电解产物全部转化为NH4NO3,需补充物质A,A是__________。
试题篮
()