某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:
① 用直流电电解氯化铜溶液,所用仪器如图:
②在电流强度为I安培,通电时间为ts钟后,精确测得某电极上析出的铜的质量为mg。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接 ,C接 , 接F。
实验线路中的电流方向为 → → →C→ → 。
(2)写出B电极上发生反应的离子方程式 ,G试管中淀粉KI溶液变化的现象为 ,相应的离子方程式是 。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极的质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿佛加德罗常数的计算表达式:NA 。
将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连,铂片与电源负极相连,以电流强度1A通电10min,然后将电源反接,以电流`强度为2A继续通电10min。试回答:
(1)铜电极和铂电极质量为横坐标,时间为纵坐标,分别作出铜电极、铂电极的质量和时间的关系图。
(2)上述过程中发生的现象是:铜电极 ;
铂电极 。
(3)最后时刻两电极的电极反应式:
铜电极 ;
铂电极 。
铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%
的NaOH溶液,需要称取 gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式 。
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
阳极
阴极
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与NaOH溶液反应制得纯净的白色的Fe(OH)2沉淀,若用下图实验装置,则可制得。两极材料分别为石墨和铁。
⑴a电极材料为 ,电极反应为 。
⑵电解液d可以是 ,则白色沉淀在电极上产生;也可以是 ,,则白色沉淀在两极之间的溶液中产生。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
⑶液体c为苯,作用是 ,
在加苯之前对d溶液进行加热处理的目的是
。
⑷为了短时间内看到白色沉淀可采取的措施是( )
A.该用稀硫酸作电解质溶液 B.适当增大电源电压
C.适当缩小两极的距离 D.适当降低电解液温度
如图所示,装置B部分盛有1 L 2 mol/L Na2SO4溶液,装置A部分盛有1 L 2 mol/L AgNO3溶液。通电后,湿润的KI淀粉试纸的C端变蓝色,试回答下列问题:
⑴A中发生反应的化学方程式为 。
⑵在B中观察到的现象是 。
⑶室温下,若从电解开始到时间为T时,A、B装置中共收集到气体0.168L(标准状况),若电解过程中无其它副反应发生,且溶液体积变化忽略不计,则在时间T时,A溶液的c(H+)为 。
如图为相互串联的甲乙两个电解池,E、F为直流电源的两个电极。乙池溶液是滴有酚酞的食盐水电解过程中,发现电极D附近先变红。请回答:
⑴电源E极为 极。
⑵甲池若为精炼铜的装置,A极是 极,材料是 ,电极反应为
;B极是 极,材料是 ,电极反应为 ,电解质溶液为 。
⑶若甲池阴极增重12.8g,则乙池阴极放出气体在标准状况下的体积为 。
现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl 2。请回答下列问题:
⑴在电解过程中,与电源正极相连的电极上所发生的电极反应式为 。
⑵电解之前,食盐水需要精制,目的是除去粗盐中的、Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为(填试剂序号) 。
⑶如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)Cl2,这时溶液的pH值是 (填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变) 。
⑷若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是
。
现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl 2。请回答下列问题:
⑴在电解过程中,与电源正极相连的电极上所发生的电极反应式为 。
⑵电解之前,食盐水需要精制,目的是除去粗盐中的、Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为(填试剂序号) 。
⑶如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)Cl2,这时溶液的pH值是 (填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变) 。
⑷若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是
。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2 2NH3,则在电化学合成氨的过程中,阳极反应式为 ,阴极反应式为 。
2NH3,则在电化学合成氨的过程中,阳极反应式为 ,阴极反应式为 。
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)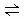 2NH3(g) △H<0,其化学平衡常数K与t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与t的关系如下表:
| t/K |
298 |
398 |
498 |
…… |
| K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试确定K1的相对大小,K1 4.1×106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.2v(NH3)(正) =3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是 。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为( )
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[OH-]>[H+]
D.[NH4+]>[Cl-]>[H+]>[OH-]
试题篮
()