按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为___________ , B池为______________
(2)锌极为__________极,电极反应式为_______________ __________
(3)石墨棒C1为______极,电极反应式为__________ _____________
石墨棒C2附近发生的实验现象为________________ ____________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。
如图:以一铜锌合金为阳极,一纯铜为阴极(起始时两电极质量相等),进行电解,电解液为硫酸铜溶液,当外电路有1.806×1023个电子转移时,阴极比阳极重19.25g,求铜锌合金中铜的质量分数。
(已知:电极反应式为 阳极: Zn-2e-=Zn2+、Cu-2e-=Cu2+
阴极:Cu2+ +2e-="Cu " )
电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和CuSO4溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
②在Y电极附近观察到的现象是
(2)若X、Y都是铜电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后X电极上有12.8g铜析出,此时直流电源已输出 mol电子。
(3)用石墨电极电解100mLH2SO4和CuSO4混合液,通电一段时间后,两极各出现气体3.36L(标准状况),求原来溶液中CuSO4的浓度 。
(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是① 反应,② 反应。
| A.C(s)+H2O(g)==CO(g)+H2(g):△H>0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O(l)+8H2O(l)△H>0 |
| C.CaC2(s)+2 H2O(l)==Ca(OH)2(s)+C2H2(g);△H<0 |
| D.CH4(g)+2O2(g)==CO2(g)+2H2O(l):△H<0 |
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为: 。
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为____________mol.
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。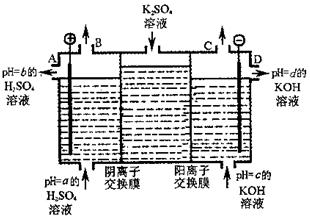
①该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B口与C口产生气体的质量比为 。
某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:____________ 阳极:____________
(2)回答观察到A装置中的现象:
①_________ ;
②烧瓶中液面上升到高于左侧尖嘴一定程度后又逐渐下落至与尖嘴相平;
③________ 。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b。再观察C装置,若无现象,说明理由,若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见。
_______________________________________________________________________。
(6分)试回答下列问题(温度均为25℃时):
(1)将0. 2mol / L HB溶液与0.1 mol / LMOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液中由水电离出的c(H+)__ __0. 2 mol / L HB溶液中由水电离出的c(H+)。(填“>”、“<”或“="”" )
(2)pH=13的Ba(OH)2溶液a L与pH=3的HCl溶液b L混合。若所得混合溶液呈中性,
则a∶b= ;
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为________________________________。
、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题:
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的 
| A.盐酸 | B.NaCl固体 | C.NaCl溶液 | D.HCl气体 |
(2)若两池中均盛有200mL 2mol•L-1CuSO4溶液:
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气体的体积为(标准状况下)

如图是一个用铂丝作电极,电解稀的溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的
变色范围:6.8~8.0,酸色-红色,减色-黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是(填编号);
①管溶液由红变黄;②
管溶液由红变黄;
③管溶液不变色;④
管溶液不变色;
(2)写出管中发生反应的反应式:;
(3)写出管中发生反应的反应式:;
(4)检验管中气体的方法是;
(5)检验管中气体的方法是;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是。
按下图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。
(1)接电源负极的石墨棒上现象 电极反应为
(2)接电源正极的石墨棒上现象, 电极反应为
电解反应的化学方程式
(3)在上述电解反应中,被氧化的物质是 离子
(4)如何验证阳极产生的气体:
如下图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
(1)打开K2,合并K1.B为 极,A的电极反应为 ,最终可观察到的现象是 .
(2)打开K1,合并K2.E为 极,F极的电极反应为 ,
检验F极产生气体的方法是 .
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 ,原因是 .
金属镍(Ni)的应用越来越广泛。
(1)LiNiO2常用作锂离子电池的正极材料,负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
xLi+Li1-xNiO2 LiNiO2
LiNiO2
LiNiO2中,Ni元素的化合价为 ;充电时,LiNiO2中化合价发生变化的元素有 (填元素符号)
(2)Ni常被镀在金属制品上以保护金属不生锈。镀镍的方法有:
方法Ⅰ: 电镀镍。以NiSO4为电镀液。
① 待镀零件与电源 相连,金属镍板与电源 相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni + + H2PO3-+
(b)6H2PO2- + 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
② 请在答题卡上写出并配平反应式(a)。
③ 化学镀与电镀相比较,在原理上的相同点是: 。 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应:
利用该反应可以提纯粗Ni,得到高纯度的金属Ni。
① 该反应的平衡常数表达式为
② 生产中,在如图所示密闭容器中充入CO气体,粗Ni放置在 (填编号) A.低温区 B.高温区
A.低温区 B.高温区
某实验小组利用饱和食盐水、导线、直流电源(用“ ” 或“
” 或“ ”表示)、烧杯、灵
”表示)、烧杯、灵
敏电流计(用“ ”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象产生,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。
请根据上述同学的实验现 象回答以下问题:
象回答以下问题:
(1)M电极棒材料是(写化学式) ,N电极棒材料是(写化学式) 。
(2)在下列虚框内完成对应三个同学的装置图:
(3)按要求写出三个同学实验过程中涉及的反应方程式:
甲同学N电极方程式
乙同学总反应的离子方程式
丙同学N电极方程式
(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因:
 。
。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式) 。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3[Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是 。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为 极;
(2)写出电解前后各溶液的pH变化情况(增大、减小或不变 ):
):
甲溶液 ;乙溶液 ;丙溶液 ;
(3)电极b上生成的气体在标准状态下的体积是 ;
电极c的质量变化是 g。
请按要求完成下列反应的式子。
(1)银锌纽扣电池(总反应:Ag2O+Zn= 2Ag+ZnO,电解质溶液:氢氧化钾)的正极反应:______________________________________________________
(2)电解以下溶液:
A. 当电解质溶液为硝酸银溶液、阳极材料为银、阴极材料为铜的阳极反应:______________________________________________________
B. 当电解质溶液为氯化钠溶液、阳极阴极材料均为石墨的阴极反应:
______________________________________________________
C. 将A中的阳极材料改为石墨,其它条件不变时的电解总反应:
______________________________________________________
(3)请你任选一种离子,这种离子既能电离又能水解,分别写出其电离与水解的离子方程式:
电离:______________________________________________________
水解:______________________________________________________
(4)已知每分解1g NH4NO3晶体放出0.53 kJ(298K,101KPa)热量,同时生成笑气(N2O)与液体水。请根据上述信息写出NH4NO3晶体分解的热化学方程式:______________________________________________________
(共6分,每空2分).从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________________________;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是________________________________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_________________________________。
试题篮
()