(届山东省烟台市高三3月模拟化学试卷)
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6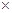 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
(届广东省华附、省实、深中、广雅高三四校联考理综化学试卷)
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象 。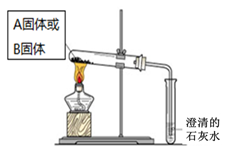

(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是 。
A.装置I的气球体积较大 B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
| 实验方案 |
预测现象 |
预测依据 |
实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色 沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 |
有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色 沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1: ;实验2: 。
(届四川省泸州市高三第一次诊断性考试化学试卷)
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。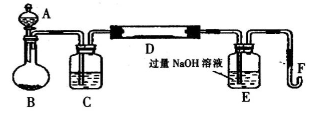
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_ ;E瓶的作用是_ 。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_ ;④中盛装KMnO3溶液的仪器是_ 。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_ 。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
(届河南省中原名校高三下学期第一次联考化学试卷)
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO -152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
(届浙江省温州市十校联合体高三上学期期中联考化学试卷)
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ 表Ⅱ
| 编号 |
V (Na2CO3)/mL |
沉淀情况 |
|
编号 |
反应温度/℃ |
沉淀情况 |
| 1 |
2.8 |
多、蓝色 |
|
1 |
40 |
多、蓝色 |
| 2 |
2.4 |
多、蓝色 |
|
2 |
60 |
少、浅绿色 |
| 3 |
2.0 |
较多、绿色 |
|
3 |
75 |
较多、绿色 |
| 4 |
1.6 |
较少、绿色 |
|
4 |
80 |
较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是 。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
(届四川省眉山市高三第一次诊断性考试化学试卷)
根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。
回答下列问题:
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用 装置(填下图字母代号),如何检验所选装置的气密性 。
(2)装置2中所盛试剂为 。
A.NaOH溶液 B.饱和NaHCO3溶液
C.饱和Na2CO3溶液 D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到 现象时,再点燃酒精灯,这步操作的目的是 。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净 。
②该探究得出钠与二氧化碳反应的化学方程式为 。
(届陕西省延安市秋高考模拟理综化学试卷)
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程________________。
(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_______
II.实验装置如图所示:
(1)写出浓硝酸受热分解的化学方程式:__________________________________。
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持 木条的燃烧”的结论。你认为这一结论是否正确?________(填“正确”或“不正确”),理由是 。
III.为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。_________________________________________________。
(届北京市海淀区高三第二学期适应性练习理综化学试卷)
某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
| 序号 |
浓硝酸与水的体积比 |
实验现象 |
| Ⅰ |
1:1 |
反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ |
1:3 |
反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ |
1:5 |
反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
铜与稀硝酸反应的离子方程式为 ;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为 g(小数点后保留两位有效数字)。
依据上表,制备NO气体最适宜的是实验II,理由是 。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到 ,说明装置的气密性良好。
②步骤Ⅲ操作的目的是 。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是 ,能确定NO完全被溶液吸收的现象是 。
(届东北三省四市高三第一次模拟考试理综化学试卷)
铁触媒(铁的氧化物)是合成氨工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)若通入Cl2不足量,溶液B中还含有 会影响测定结果。
(3) 若通入Cl2过量且加热煮沸不充分,溶液B中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol L-1酸性KMnO4溶液、紫色石蕊试液、淀粉-KI溶液、0.1mol L-1 KSCN溶液、 品红稀溶液
| 实验操作 |
实验现象与结论 |
| 取适量溶液B于试管中,滴加 ,振荡 ,放置一段时间后,观察现象。 |
若溶液 ,则溶液B中含Cl2; 若溶液 ,则溶液B中不含Cl2。 |
方案二 :用下列装置测定铁触媒的含铁量,确定其组成。
(4)干燥管C的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得干燥管B增重ll.0g,则该铁触媒的化学式可表示为 。
含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。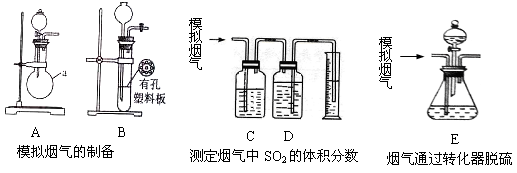
回答下列问题:
Ⅰ.模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为 。
(2)用B装置制CO2,使用该装置优点的是 。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是 、 。(填序号)
①KMnO4溶液;②饱和NaHSO3溶液;③饱和Na2CO3溶液;④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数是 。
Ⅲ.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出催化剂参与反应过程的离子方程式 ①SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+ ② 。
(7)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经 、洗涤、 、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是 。
氯离子插层镁铝水滑石 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为 和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。
和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。
(1) 热分解的化学方程式为 。
热分解的化学方程式为 。
(2)若只通过测定装置C、D的增重来确定 ,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 。装置连接后,首先要进行的操作名称是 。
,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 。装置连接后,首先要进行的操作名称是 。
(3)加热前先通 排尽装置中的空气,称取C、D的初始质量后,再持续通入
排尽装置中的空气,称取C、D的初始质量后,再持续通入 的作用是 、 等.
的作用是 、 等.
(4)完全分解后测得C增重3.65g、D增重9.90g,则 = .若取消冷却玻管B后进行试验,测定
= .若取消冷却玻管B后进行试验,测定 值将 (填“偏高”或“偏低”)
值将 (填“偏高”或“偏低”)
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1—2y(CO3)y·zH2O],该生成物能发生类似的热分解反应,现以此物为样品,用(2)中连接的装置和试剂进行实验测定 ,除测定D的增重外,至少还需测定 .
,除测定D的增重外,至少还需测定 .
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: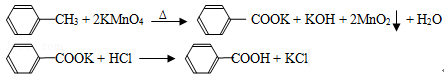
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。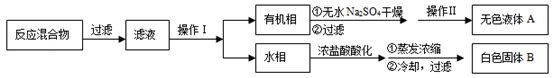
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象 |
结论 |
| |
将白色固体B加入水中,加热溶 解, |
得到白色晶体和无色溶液 |
----------------- |
| ② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl— |
| ③ |
干燥白色晶体, |
|
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明________
②称取Mg(NO3)2固体3 .79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_____________________(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应1”反应速率的措施有 。(回答一点即可)
(2)“反应1” 的离子方程式是 。
(3)“反应2”的氧化剂是 ,该反应的化学方程式为 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:
(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
试题篮
()